POTASSIUM
Le potassium, troisième élément de ce groupe, possède les propriétés caractéristiques des métaux alcalins. Il a été découvert en 1807 par Humphry Davy lors de la réduction électrolytique de la potasse caustique fondue (KOH). Son symbole chimique K (du nom allemand Kalium ) et son nom français et anglais (potassium) dérivent de la potasse (carbonate K2C3). Ce constituant principal des cendres de végétaux terrestres s’appelle perlasse en français (de l’anglais pearl ash ), Pottasche (cendres de pot) en allemand et qal 稜 en arabe (également à l’origine des mots «alcali» et «alcalin»). Dans l’industrie des engrais, le terme «potasse» désigne encore le chlorure de potassium KCl dont la teneur en élément fertilisant (K+) s’exprime sous forme d’oxyde K2O, ce qui peut entraîner des confusions supplémentaires.
Le potassium, de poids atomique K = 39,098 et de numéro atomique Z = 19, a pour structure électronique fondamentale 1 s 2; 2 s 2; 2 p 6; 3 s 2; 3 p 6; 4 s 1. Très électropositif, il perd facilement son électron de valence 4 s 1 en formant avec les éléments non métalliques des composés généralement à liaisons ioniques. Le cation K+, de même rayon que l’ion ammonium NH4+, peut le remplacer dans de nombreux sels (solution solide de substitution). Les isotopes naturels de nombre de masse 39, 40 et 41 ont des teneurs respectives de 93,26, 0,01 et 6,73 p. 100. Il existe aussi des isotopes artificiels de nombre de masse 36 à 38 et 42 à 50. L’isotope 40K radioactif (période 1,3 憐 109 ans), émetteur 廓 et 塚, permet le contrôle continu automatisé de la concentration des saumures industrielles. Sa transmutation partielle en 40Ca et 40Ar occlus dans les roches potassiques et dosables par spectrométrie de masse conduit à la détermination de leur âge ou datation.
État naturel et extraction
Le potassium est relativement abondant dans l’écorce terrestre, dont la teneur (2,6 p. 100) est sensiblement égale à celle en sodium. Trop altérable pour exister à l’état natif, il se trouve combiné surtout dans des roches peu solubles, essentiellement des silicoaluminates tels que la leucite KAlSi26, le feldspath orthose KAlSi38 et des micas, dont la muscovite KAl2Si3Al10(OH)2.
Outre l’alunite KAl3(SO4)2(OH)6, qui se rencontre dans les terrains volcaniques, les sels naturels solubles sont surtout les chlorures dans les gisements miniers provenant de l’évaporation des mers: la sylvine ou sylvite KCl; la sylvinite, mélange intime en proportions variables de chlorures de sodium et de potassium; la carnallite, sel double, MgCl2, KCl, 6H2O, et la rinnéite, K3NaFeCl6.
Certains gisements marins (Stassfurt) contiennent aussi des sulfates doubles tels que la schönite MgS4, K2S4, 6H2O; la polyhalite 2 CaS4, MgS4, K2S4, 2 H2O; la syngénite CaS4, K2S4, H2O; la langbeinite K2S4, 2 MgS4; ou des sels doubles tels que la kaïnite MgS4, KCl, 3 H2O; le Hartsalz est un mélange de sylvine et de kiesérite (MgSO4, H2O).
Par ordre d’importance décroissante des réserves difficilement chiffrables, les principaux gisements exploités se situent ainsi (les chiffres entre parenthèses indiquent la production exprimée en millions de tonnes de K2O pour l’année 1982): Kama (Oural), Turkménistan, Ouzbékistan, Biélorussie en ex-U.R.S.S. (8,5); Allemagne (5,56); Saskatchewan au Canada (5,29); Californie, Utah, Nouveau-Mexique, Texas aux États-Unis (1,75); Alsace en France (1,70); mer Morte en Israël (1,0); Catalogne, Navarre, Sôria en Espagne (0,69; Grande-Bretagne (0,24); Italie (0,11). Les capacités de production tendent à croître plus rapidement que la consommation (environ 5 p. 100 par an). De nombreux autres gisements sont exploités ou en cours d’équipement (Chine, Chili, Brésil, Australie, Congo, Maroc, Éthiopie, Jordanie, Pologne, Roumanie...).
En gisement fossile, la «potasse» s’extrait habituellement par mine (puits et galeries) et rarement par dissolution in situ (saumure pompée). Après élimination éventuelle des impuretés (schistes, argiles, sulfates de calcium), les sels sont généralement séparés par deux procédés: la cristallisation fractionnée et la flottation. La première est utilisée pour la sylvinite et la carnallite. Le chlorure KCl, dont la solubilité diminue beaucoup avec la température, se dépose, de préférence à NaCl ou MgCl2, en solution saline saturée à chaud puis refroidie (ou surconcentrée par évaporation). On emploie la flottation pour la sylvinite broyée et dispersée dans une eau mère froide: grâce à un collecteur (acétate d’amine grasse à longue chaîne), la sylvite KCl est entraînée par la mousse en surface.
Toutes les mers du globe renferment le cation potassium K+, mais la teneur (0,05 p. 100) est très inférieure à celle de son homologue Na+. Malgré sa dilution dans l’eau de mer, K+ peut être extrait industriellement par précipitation de sels peu solubles avec des réactifs tels que la dipicrylamine. La concentration par évaporation de la mer Morte fait cristalliser du sel marin (NaCl) puis la carnallite (KCl, MgCl2, 6 H2O).
Le potassium, élément essentiel à la vie végétale et animale, se concentre dans les cendres de végétaux terrestres et parfois marins (varech), les résidus industriels de betterave, le suint de laine de mouton, dont on peut l’extraire sous forme de carbonate par action de l’eau.
Industriellement, le potassium se prépare en petites quantités par voie thermochimique, le réducteur étant le sodium pour KCl et KOH, le carbure de calcium pour KCl et KF, le silicium en présence de chaux vive vers 1 100 0C pour KF, K2C3 ou, mieux, KOH.
Au laboratoire, on réduit soit le chlorure KCl par le calcium, soit un métallate (K2S4; K2Cr4) par le titane ou le zirconium, à 600 0C et sous vide.
Dans ces procédés, le potassium volatil distille, ce qui assure sa purification. Les traces de sodium et de calcium éventuellement entraînées peuvent être insolubilisées par oxydation sélective en oxydes séparés par filtration vers 65 0C.
Le métal se conserve sous huile minérale ou de préférence sous vide dans des conteneurs d’acier ou de verre.
Propriétés physico-chimiques
Propriétés physiques
Métal blanc brillant et mou, le potassium cristallise avec une structure de type cubique centré (arête de la maille 0,533 nm) et sa densité est égale à 0,86 à 20 0C. Il fond à 63,65 0C et bout vers 757 0C. Sa tension de vapeur atteint 133,32 hPa vers 584 0C. Quelques autres constantes physiques intéressantes sont les suivantes: la résistivité électrique à 18 0C est de 6,7 憐 10 size=1漣6 行.cm, la conductibilité thermique à 200 0C est de 44,78 W/cm.0C.s; le potentiel normal de l’électrode K/K+, de 漣 2,92 V; l’énergie de première ionisation, de 4,32 eV. Le spectre d’émission est caractérisé par une flamme colorée en rouge-violet et par des raies doubles dans le visible: 769,9 et 766,4 nm (rouge), 404,7 et 404,4 nm (violet). Le spectre de flamme permet l’identification et le dosage spectrophotométrique.
Propriétés chimiques
Très réactif, même à la température ordinaire, le potassium s’unit à de nombreux fluides (hydrogène, oxygène, eau, halogènes, gaz carbonique, oxydes d’azote et de soufre). Il s’enflamme à l’air, mais, dans l’oxygène pur, vers 20 0C, la présence de traces d’eau est nécessaire pour amorcer la réaction. L’oxydation ménagée conduit à des mélanges d’oxydes, essentiellement K2O blanc et K2 jaune. Il existe aussi le peroxyde K22 blanc et l’ozonide K3 orange très instable. Ces oxydes réagissent violemment avec l’eau en donnant la potasse caustique KOH (et un dégagement d’oxygène pour les homologues supérieurs à K2O).
L’énergie de formation élevée de l’oxyde K2O ( G0298 = 漣 322 kJ/mole) permet la réduction complète de nombreux oxydes métalliques par le potassium. Les oxydes réfractaires purs (MgO, Al23, Th2) résistent convenablement, mais le verre est attaqué nettement à partir de 300 0C et la silice l’est vers 500 0C. D’autres oxydes conduisent à des sels ou à des oxydes mixtes dans certaines conditions.
L’eau attaque violemment le potassium en formant de l’hydroxyde alcalin KOH et de l’hydrogène qui donne un mélange tonnant avec l’oxygène de l’air.
La potasse caustique KOH, solide blanc fondant sans décomposition vers 400 0C, est une base forte. Elle s’obtient industriellement par électrolyse du chlorure KCl en solution aqueuse, avec production simultanée de chlore et d’hydrogène. Avec ce gaz (H2), le potassium forme l’hydrure composé blanc, ionique K+H size=1漣, dissociable en ses éléments à partir de 200 0C.
Les halogènes X2 réagissent violemment en donnant des halogénures alcalins KX blancs, thermiquement très stables. Divers défauts réticulaires se traduisent par des centres colorés (avec des bandes d’absorption du bleu au rouge ou bien au-delà du spectre optique): on remarque surtout la non-stœchiométrie par lacune anionique KCl1 size=1漣 size=1﨎 (centres F, M, N, R...), éventuellement par lacune cationique K1 size=1漣 size=1﨎Cl (centres V) et par des impuretés cationiques (centres A, Z...).
La vapeur de soufre, vers 250 0C, conduit au sulfure K2S blanc déliquescent. Il existe divers polysulfures K2Sn (n = 2 à 6), dont les couleurs vont du jaune au rouge.
L’azote ne se combine qu’après activation en donnant le nitrure K3N blanc. L’azoture K3, mieux connu, peut exploser par suite d’un choc ou à la chaleur. L’amidure KNH2 blanc, hydrolysable en KOH et NH3, se forme à côté d’hydrogène par action d’ammoniac gazeux à chaud ou plus lentement dans l’ammoniac liquide, bon solvant du potassium. Cette solution, peu stable, de coloration allant du bleu au rouge doré selon la concentration, contient des cations K+ et des électrons solvatés; elle présente un grand intérêt théorique et quelques applications en réductions minérales ou organiques. Certaines amines et des sels fondus (KCl, KOH...) dissolvent également le potassium.
Les sels de potassium sont généralement solubles dans l’eau sauf le perchlorate KCl4, le fluosilicate K2Si6, l’hexachloroplatinate K2(PtCl6), le picrate, l’hydrogénotartrate et quelques dérivés organiques.
Composés
Le sulfate K2S4 provient de la cristallisation sélective des solutions de sels doubles et triples, ainsi que de la conversion du chlorure par la kiesérite MgS4, H2O ou par l’acide sulfurique H2S4. Il forme des sels doubles avec l’hydrogénosulfate KHS4 dont la condensation vers 600 0C conduit au pyrosulfate K2S27.
Le nitrate K3 (nitre ou salpêtre) se forme naturellement par l’oxydation de dérivés ammoniacaux par les bactéries nitrifiantes en présence des sels potassiques (nitrières). Industriellement, il se prépare à partir du chlorure KCl par double décomposition avec le nitrate de sodium Na3 ou par action de l’acide nitrique.
Les phosphates , en général déliquescents, sont principalement KH2P4 (orthophosphate diacide dit K.D.P., ferroélectrique avec C = 123 K), K4P27, 3 H2O (pyrophosphate) et (KPO3)n (polymétaphosphate).
Le carbonate K2C3, sel blanc fondant vers 900 0C, s’extrait des résidus d’origine organique déjà cités et se prépare surtout par carbonatation de la potasse caustique ou parfois du chlorure KCl en présence d’amine. La solution aqueuse est fortement alcaline par hydrolyse. Il existe plusieurs hydrates, un hydrogénocarbonate KHC3, et un sesquicarbonate. Le carbonate commercial peut être un mélange impur de composition variable selon l’origine du sel.
Le potassium s’allie à de nombreux métaux: Na, Rb, Cs, Au, Be, Cd, Hg, Ga, Pb, Sn, etc. Certains alliages sont liquides à la température ordinaire; par exemple, l’eutectique Na-K (à 77 p. 100 en poids ) fond à 漣 12,5 0C.
Avec le graphite, le potassium forme des composés d’insertion lamellaires dont C8K brun doré et C24K bleu, décomposés par la chaleur. Certains sulfures métalliques (TiS2, ZrS2, MoS2) à structure feuilletée permettent également des composés intercalaires Kx MeS2. Il existe aussi des composés d’inclusion avec le bore et le silicium.
L’acétylène, vers 200 0C ou dans la solution K-NH3 liquide, donne le monoacétylure HC 令CK dont la thermolyse conduit au diacétylure ou carbure C2K2; ces deux composés incolores sont hydrolysables en KOH et C2H2.
Les organopotassiques, moins variés et moins utilisés que leurs homologues lithiques, présentent une tendance ionique R size=1漣K+ et se répartissent en deux groupes:
– type I incolore dit de substitution (avec R = CH3... C6H5...) et les complexes dérivés tel K[Al(C2H5)4] ou K[Li (C6H5)2];
– type II coloré, dit de substitution (R = C(C6H5)3...) ou d’addition sur une liaison non saturée de molécule aliphatique ou aromatique.
La charge négative, plutôt localisée sur un carbone dans les composés I, tend à se délocaliser sur le radical R dans les dérivés II, moins réactifs et plus solubles dans l’éther. Ces organopotassiques, comme leurs homologues alcalins, permettent des synthèses organiques variées par addition ou échange.
Propriétés physiologiques et biologiques
Dans les cellules animales, l’ion K+, échangeable avec Na+, intervient lors de phénomènes bioélectriques des systèmes excitables (nerfs, muscles, etc.). Il s’avère indispensable au métabolisme glucidique et protidique ainsi qu’à la croissance (cf. métabolisme HYDROMINÉRAL). L’hypokaliémie (carence en K+) et l’hyperkaliémie (excès de K+) entraînent des troubles musculaires, digestifs et autres. L’hydroxyde KOH attaque les muqueuses et les chairs.
Dans les plantes, le potassium favorise la photosynthèse [cf. PHOTOSYNTHÈSE] ainsi que la formation et la migration des glucides et des protides. Il améliore la résistance à la sécheresse, au froid, à la verse et aux maladies cryptogamiques.
Applications
Le potassium métallique reste beaucoup moins utilisé que le sodium, plus facile à manipuler et plus économique. Il permet toutefois de fabriquer des cellules photoélectriques, et, allié au sodium, il a été utilisé comme fluide échangeur thermique dans des circuits de refroidissement de piles atomiques (cf. réacteurs NUCLÉAIRES), mais son emploi reste essentiellement lié aux applications chimiques (réduction).
Dissous dans l’ammoniac liquide (formation de KNH2), il catalyse son enrichissement en ND3 par échange isotopique hydrogène-deutérium avec le gaz de synthèse 2 + 3 H2 (synthèse de l’eau lourde D2O).
Les sels de potassium ne s’utilisent que pour des raisons techniques lorsque leurs homologues sodiques, meilleur marché, ne conviennent pas. Ils sont généralement peu hygroscopiques: le cation K+ à grand rayon se solvate faiblement. Cet ion est souvent un promoteur de catalyseurs (oxydes métalliques) et l’un des principaux éléments fertilisants en agriculture.
Le superoxyde K2 et l’oxylithe, dérivé de l’alliage NaK peroxydé, s’emploient comme sources d’oxygène et épurateurs d’atmosphère (appareils respiratoires autonomes et capsules spatiales ou sous-marines). Ils absorbent le gaz carbonique et la vapeur d’eau expirés en libérant de l’oxygène.
L’hydroxyde et le carbonate interviennent dans la fabrication des savons mous et des décapants de peinture; l’hydroxyde s’utilise comme électrolyte d’accumulateur alcalin détergent, comme réactif basique et absorbeur de gaz carbonique. Le carbonate, employé surtout en verrerie et émaillerie, comme le nitrate et le sulfate, permet aussi la fabrication d’autres sels potassiques. Le nitrate et le chlorate s’emploient en pyrotechnie: la poudre noire est un mélange de 2 K3 + S + 3 C, fabrication des allumettes. Le chlorate est un herbicide comme le sel sodique. Les silicates en solution aqueuse, «liqueur des cailloux», durcissent les pierres calcaires trop tendres.
On se sert des halogénures KBr et KI en médecine et en photographie. Le pentasulfure, constituant du «foie de soufre», permet de préparer des bains sulfureux artificiels. L’hydrogénosulfite est un agent désinfectant et un réactif photographique et l’hydrogénocarbonate constitue une poudre extinctrice. D’autres sels s’utilisent surtout comme réactifs: cyanure KCN, hexacyanoferrates K4[Fe(CN)6] et K3[Fe(CN)6], thiocyanate KSCN, chromate K2Cr4 et bichromate K2Cr27, permanganate KMn4. Les principaux engrais potassiques sont les suivants: le chlorure ou sylvine (58 à 63 p. 100 K2O), la sylvinite (25 p. 100 K2O), la sylvinite double (40 p. 100 K2O), le sulfate (48 p. 100 K2O), l’hydrogénocarbonate (46 p. 100 K2O), le nitrate (44 à 47 p. 100 N et 13 à 14 p. 100 K2O), les binaires phosphapotassiques, mélanges de phosphates et de sylvine, ou composés tel le polymétaphosphate (57 p. 100 P25 et 37 p. 100 K2O). En thérapeutique enfin, les sels potassiques facilitent certains traitements diurétiques et hormonaux.
potassium [ pɔtasjɔm ] n. m.
• 1808; lat. mod. potassium, de l'angl. potass ou potash, du néerl.
♦ Élément atomique, appelé autrefois kalium (symb. K; no at. 19; m. at. 39,0983), quatrième de la série des alcalins, métal mou, blanc d'argent, très réactif et oxydable. ⇒vx kalium. Les sels de potassium constituent un élément essentiel à la vie des plantes. Bromure de potassium : sel cristallisé, utilisé dans les émulsions photographiques, en lithographie. Chlorure de potassium, utilisé comme engrais. Cyanure de potassium, poison violent.
● potassium nom masculin (anglais potassium, de potass, potasse) Métal alcalin, découvert dans la potasse. (Élément chimique de symbole K.) Numéro atomique : 19 Masse atomique : 39,102 Masse volumique : 0,86 g°cm3 Température de fusion : 63,65 °C
potassium
n. m. élément alcalin (symbole K) de numéro atomique Z = 19.
— Datation au potassium-argon: V. datation.
— Métal (K). (L'ion K +, très répandu dans la nature sous forme de sels, est indispensable à l'organisme.)
⇒POTASSIUM, subst. masc.
CHIM. Métal alcalin mou, extrait de la potasse, blanc argenté, très réactif, très oxydable et largement répandu dans la nature sous forme de divers sels (symb. K, n° atomique 19, poids atomique 39,1, densité 0,86). La soude est plus abondante que la potasse dans les eaux minérales actuelles et dans les émanations volcaniques. Ainsi, le potassium et le sodium ont joué un rôle à peu près analogue; mais le potassium a joué son rôle plus anciennement (ÉLIE DE BEAUMONT ds B. de la Sté géol. Fr., t. 4, 1847, p. 45). Potassium, élément légèrement radioactif toujours présent dans le corps humain (GOLDSCHMIDT, Avent. atom., 1962, p. 219).
— [Dans des syntagmes désignant des composés du potassium] Administration de sirop de morphine ou de bromure de potassium. Mais en raison de son caractère infectieux la méningite demande aussi un traitement antimicrobien général (GARCIN, Guide vétér., 1944, p. 129). Les matières premières utilisées le plus souvent en France, sont: le nitrate d'ammoniaque, le superphosphate et le chlorure de potassium (Industr. fr. engrais chim., 1956, p. 20).
♦Hydroxyde de potassium. Synon. de potasse caustique.
♦Permanganate de potassium. Sel (de formule MnO4) utilisé, surtout dans les infections cutanées, comme antiseptique, en dilution à 0,1% ou moins (d'apr. Méd. Biol. t. 3 1972). Hertz lui-même étudia la constante diélectrique de substances aussi diverses que la résine, l'améthyste, le permanganate de potassium et le gaz carbonique (Hist. gén. sc., t. 3, vol. 2, 1964, p. 275).
SYNT. Acétate, azotate, bichromate, cyanure, ferrocyanure, iodure, nitrate, nitrite, oxalate, perchlorate, phosphate, propionate, prussiate, salicylate, silicate, sulfate, tartrate de potassium.
Prononc. et Orth.:[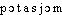 ]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1808 (Bibl. britannique ... Sc. et arts, t. 39, p. 49: Potasium; p. 70: potassium). Mot forgé en 1807 par le chimiste angl. H. Davy (Philosophical transactions, t. 98, 1808, p. 32: potasium; p. 336: potassium) sur l'angl. potash, potass «potasse», avec le suff. -ium des noms de métaux. La trad. fr. de l'art. angl. de H. Davy a paru en 1808 dans la Bibl. britannique (cf. supra), puis dans les Ann. chim. et phys., t. 68 (potasium, p. 254). Fréq. abs. littér.:31. Bbg. BONN. 1920, p.109.
]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1808 (Bibl. britannique ... Sc. et arts, t. 39, p. 49: Potasium; p. 70: potassium). Mot forgé en 1807 par le chimiste angl. H. Davy (Philosophical transactions, t. 98, 1808, p. 32: potasium; p. 336: potassium) sur l'angl. potash, potass «potasse», avec le suff. -ium des noms de métaux. La trad. fr. de l'art. angl. de H. Davy a paru en 1808 dans la Bibl. britannique (cf. supra), puis dans les Ann. chim. et phys., t. 68 (potasium, p. 254). Fréq. abs. littér.:31. Bbg. BONN. 1920, p.109.
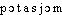 ]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1808 (Bibl. britannique ... Sc. et arts, t. 39, p. 49: Potasium; p. 70: potassium). Mot forgé en 1807 par le chimiste angl. H. Davy (Philosophical transactions, t. 98, 1808, p. 32: potasium; p. 336: potassium) sur l'angl. potash, potass «potasse», avec le suff. -ium des noms de métaux. La trad. fr. de l'art. angl. de H. Davy a paru en 1808 dans la Bibl. britannique (cf. supra), puis dans les Ann. chim. et phys., t. 68 (potasium, p. 254). Fréq. abs. littér.:31. Bbg. BONN. 1920, p.109.
]. Att. ds Ac. dep. 1835. Étymol. et Hist. 1808 (Bibl. britannique ... Sc. et arts, t. 39, p. 49: Potasium; p. 70: potassium). Mot forgé en 1807 par le chimiste angl. H. Davy (Philosophical transactions, t. 98, 1808, p. 32: potasium; p. 336: potassium) sur l'angl. potash, potass «potasse», avec le suff. -ium des noms de métaux. La trad. fr. de l'art. angl. de H. Davy a paru en 1808 dans la Bibl. britannique (cf. supra), puis dans les Ann. chim. et phys., t. 68 (potasium, p. 254). Fréq. abs. littér.:31. Bbg. BONN. 1920, p.109.
potassium [pɔtasjɔm] n. m.
ÉTYM. 1808; angl. potassium, 1807, Davy; lat. mod. potassium, de l'angl. potass ou potash « potasse », ou du franç. potasse.
❖
♦ Métal alcalin (symbole K, numéro at. 19; poids at. 39,096; densité 0,859; température de fusion 63,65 °C), appartenant au groupe I de la classification périodique comme les autres métaux alcalins, ayant la valence 1 et formant un ion positif univalent. || Le potassium possède divers isotopes dont l'un, le potassium 40, se trouve en très faible proportion (0,0119%) dans le potassium naturel; il est radioactif (période 1,5 milliard d'années) et joue un rôle essentiel dans le régime thermique de la terre. || Le potassium, métal mou, blanc d'argent, très réactif, se recouvre à l'air d'une croûte oxydée et carbonatée. || Minéraux contenant du potassium : sylvine (chlorure de potassium), sylvinite (mélange de chlorures de potassium et de sodium), carnallite (chlorure double hydraté de potassium et de magnésium), schœnite (sulfate double hydraté de potassium et magnésium), kaïnite (chlorosulfate double hydraté de potassium et magnésium). || Efflorescences d'azotate de potassium sur certaines roches (nitre ou salpêtre). || Les océans et les mers contiennent du chlorure de potassium (0,5 à 0,7 g par litre). || Les sels de potassium constituent un élément essentiel à la vie des plantes (les cendres de bois ont été longtemps les sources les plus importantes de potasse) : des végétaux ils passent dans les tissus animaux et peuvent s'accumuler dans certaines parties des organismes (suint des moutons).
0 — Vous connaissez la composition de l'eau de mer. Sur mille grammes on trouve quatre-vingt-seize centièmes et demi d'eau, et deux centièmes deux tiers environ de chlorure de sodium; puis, en petite quantité, des chlorures de magnésium et de potassium, du bromure de magnésium, du sulfate de magnésie, du sulfate et du carbonate de chaux.
J. Verne, Vingt mille lieues sous les mers, p. 119.
♦ Principaux dérivés du potassium : alun de potassium : sulfate double hydraté de potassium et d'un métal trivalent (généralement l'aluminium); bicarbonate ou carbonate acide de potassium (KHCO3), constituant la calcinite naturelle, poudre blanche, déliquescente, entrant dans la fabrication de certains verres; bichromate de potassium (K3Cr2O7) : sel rouge orangé utilisé industriellement comme oxydant, colorant (→ Noir, cit. 43), dans l'industrie des cuirs, etc.; bromure de potassium (KBr) : sel cristallisé, blanc, utilisé surtout dans les émulsions photographiques, ainsi qu'en lithographie et comme sédatif; carbonate de potassium (K3CO2) : sel blanc déliquescent (⇒ Potasse, 3.), sert en verrerie, parfumerie, etc.; chlorate de potassium (KClO2) : sel blanc, oxydant servant à la fabrication des allumettes et de certains explosifs (⇒ Cheddite); chlorure de potassium (KCl; ⇒ Sylvine, sylvinite) : sel blanc, soluble dans l'eau, le plus utilisé des sels de potassium (surtout comme engrais, et aussi pour la préparation des autres dérivés du potassium); cyanure de potassium (KCN) : sel blanc cristallisé constituant un poison violent; ferricyanure (anciennt, prussiate rouge) de potassium : sel rouge utilisé dans la fabrication de pigments bleus, des papiers et dans l'industrie textile; ferrocyanure (anciennt, prussiate jaune) de potassium : sel jaune utilisé dans la fabrication de pigments bleus (ferrocyanure ferrique ou bleu de Prusse), dans la préparation électrolytique de certains métaux, les industries textiles, la gravure; hydroxyde de potassium (⇒ Potasse, 1.); nitrate ou azotate de potassium (KNO3; ⇒ Nitre ou salpêtre); oxalate de potassium, se rencontre sous forme d'oxalate acide (sel d'oseille) dans les feuilles d'oseille ou « oxalis »; permanganate de potassium (⇒ Permanganate); picrate de potassium : sel jaune possédant certaines propriétés explosives; sulfate de potassium (K2SO4) : sel blanc dont l'usage le plus important est la fabrication de certains engrais; sulfures de potassium : sulfure simple (K2S), sulfure acide (KSH) et polysulfures (utilisés comme insecticides, et dont le mélange était autrefois appelé « foie de soufre »); tartrate et bitartrate de potassium (⇒ Tartre). || L'émétique ordinaire est du tartroantimoniate de potassium.
♦ Potassium-argon (radioactif), servant aux datations paléontologiques.
Encyclopédie Universelle. 2012.