ZINC
Le zinc (symbole Zn, numéro atomique 30) est un élément chimique métallique blanc bleuâtre appartenant au sous-groupe II b de la classification périodique. Quoiqu’il soit de grande consommation et que ses applications se rencontrent dans la vie courante, il est peu connu. Le zinc est cité pour la première fois sous sa dénomination actuelle par Paracelse dans son traité De re metallurgica , au début du XVIe siècle. Son exploitation industrielle a commencé en Angleterre en 1740. La production annuelle mondiale augmente lentement et dépasse 7 millions de tonnes au milieu des années 1990, les principaux pays producteurs étant, par ordre décroissant: la Chine, le Japon, le Canada, l’ex-U.R.S.S., l’Allemagne, les États-Unis, l’Espagne, l’Australie, la France, la Corée du Sud, l’Italie, les Pays-Bas... La production française pour 1993 a été de 309 800 tonnes.
1. Métallurgie
Les minerais de zinc se trouvent dans la nature sous deux formes principales: d’une part, les variétés sulfurées, blende (ou sphalérite) et wurtzite; d’autre part, les variétés oxydées, smithsonite, hydrozincite (carbonates), franklinite, zincite (oxydes), hémimorphite (ou calamine), willemite (silicates).
Les teneurs en zinc du minerai varient de 2 à 12 p. 100. Le minerai sous forme de blende est enrichi par flottation. Les minerais oxydés, qui se prêtent mal à la flottation, sont moins exploités. En 1993, les principaux pays producteurs de minerai sont, par ordre décroissant: le Canada, la Chine, le Pérou, les États-Unis, l’ex-U.R.S.S., le Mexique, l’Irlande, l’Espagne et la Suède.
Grillage des minerais
Les minerais concentrés sont le plus souvent des blendes contenant 28 à 32 p. 100 de soufre. Il est nécessaire de transformer le sulfure en oxyde par un grillage:

L’anhydride sulfureux dégagé est utilisé pour la production d’acide sulfurique. Selon la température, des réactions parasites peuvent se produire, la plus importante étant l’oxydation en sulfate:

Elle a lieu principalement entre 500 et 600 0C. En opérant à plus haute température, le sulfate de zinc est dissocié en oxyde. La température à l’intérieur des fours de grillage doit donc être maintenue à 900-950 0C pour obtenir une bonne désulfuration. Celle-ci est cependant limitée par la présence de sulfates (plomb, calcium, magnésium) non décomposés à cette température. À plus haute température (1 200 0C) et dans certaines conditions, il est possible de les décomposer et de réduire la teneur en soufre à 0,1 ou à 0,2 p. 100.
Le grillage s’effectue dans un four spécialement conçu; on a utilisé successivement les fours Delplace, les fours Spirlet, les fours Wedge, les fours Flash et les fours à lit fluidisé.
Dans les fours à lit fluidisé , le minerai est maintenu en suspension par l’air de grillage soufflé par le bas à un débit convenable. Dans certaines conditions, le lit de minerai en suspension se comporte comme un fluide; le contact air-particules de minerai est excellent, ce qui favorise la rapidité d’oxydation des sulfures. L’alimentation peut être constituée par du minerai fin ou granulé, la granulation permettant d’éviter un entraînement de poussière important. Cette technique s’est développée rapidement et tend à remplacer les autres procédés. Le minerai grillé obtenu convient très bien au procédé d’extraction par voie humide, qui se développe actuellement.
Les minerais grillés contiennent encore le plus souvent de 1 à 3 p. 100 de soufre, essentiellement sous forme de sulfate. Dans de nombreuses usines thermiques, on procède à un «supergrillage» sur une grille mécanique du type Dwight-Lloyd, où l’on traite un mélange de minerais grillés et de produits dits de retour venant d’une opération précédente. Le combustible est soit du charbon, soit de la blende crue, mélangés à la charge. L’opération, outre une bonne désulfuration (de 0,1 à 0,5 p. 100 de S), permet de donner au produit traité une structure physique très favorable à la réduction par le charbon. La haute température à laquelle est porté le produit permet d’éliminer par volatilisation une grande partie du plomb et du cadmium qu’il contient. Ces métaux sont récupérés sous forme de poussières au cours de la purification des gaz de grillage et servent de matière première à la métallurgie du cadmium.
Réduction du minerai grillé
La métallurgie du zinc repose sur deux groupes de procédés:
– l’extraction par voie sèche, appelée plus souvent voie thermique, dans laquelle l’oxyde de zinc est réduit en présence de carbone à haute température;
– l’extraction par voie humide, ou procédé électrolytique, dans laquelle l’oxyde de zinc est mis en solution dans l’acide sulfurique dilué, et le zinc extrait par électrolyse.
Extraction par voie thermique
Principe
La réduction peut être représentée par les deux réactions suivantes:
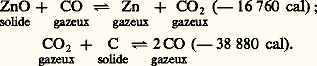
Le zinc est produit sous forme de vapeur mélangée avec de l’oxyde de carbone et un peu d’anhydride carbonique. Les gaz doivent être traités dans un système de condensation où le zinc est produit à l’état liquide.
Les températures vont de 1 100 à 1 300 0C. La vitesse globale de réduction est déterminée par la vitesse de diffusion et d’écoulement des gaz entre les points de réaction avec les constituants solides. De ce fait, la dimension et la porosité des grains de minerai et de charbon influent sur la vitesse globale de réduction.
La condensation effectuée à 500 0C environ donne du zinc liquide. Les gaz sortant du condenseur sont saturés en vapeur de zinc. Leur refroidissement fournit de la poudre, le «gris de zinc», qui représente de 2 à 8 p. 100 de la production.
Le cadmium, très volatil, se retrouve intégralement dans le zinc et la poussière de zinc produits. Le plomb, moins volatil, se partage entre les résidus et le zinc condensé.
Fours utilisés
Les fours à creusets horizontaux sont en voie de disparition. Le four New Jersey à creuset vertical (cf. MÉTALLURGIE - Métallurgie extractive, fig. 6) est un procédé en continu. Un mélange, constitué de minerais grillés et supergrillés, de charbon cokéfiant, d’argile agglomérante et de liant liquide, est aggloméré en forme de briquettes cuites à 850 0C environ. Au cours de cette cuisson, le charbon bitumineux se transforme en coke et donne une solidité exceptionnelle à la briquette. Les briquettes chaudes sont chargées en haut du four et descendent lentement vers le bas du creuset.
La réduction s’effectue dans des creusets en carbure de silicium de forme parallélépipédique, hauts d’environ 11 mètres et placés dans une chambre de chauffe. Le gaz de combustion est introduit en haut de la chambre et circule vers le bas; il est brûlé progressivement par l’introduction d’air de place en place.
La température de la chambre est maintenue entre 1 280 et 1 320 0C. Le mélange de vapeur de zinc et d’oxyde de carbone suit une marche ascendante. Les vapeurs sont dirigées, à l’aide d’un conduit en réfractaire, au condenseur qui est maintenu à 500 0C.
Un creuset peut produire jusqu’à 10 tonnes de zinc par jour. Les creusets sont groupés les uns à côté des autres en batteries de dix environ.
Dans le procédé du haut fourneau, ou procédé de l’Imperial Smelting (cf. MÉTALLURGIE - Métallurgie extractive, fig. 7), le four est alimenté par le gueulard en minerai grillé, aggloméré, coke et produits fondants. L’air est injecté par les tuyères à la base du four, à la température de 700 à 750 0C, et provoque la combustion du coke en fournissant les calories nécessaires pour la réduction de l’oxyde de zinc et la fusion de la gangue. Les gaz produits contenant les vapeurs de zinc sont dirigés dans deux condenseurs symétriques, où ils sont refroidis par une pluie de plomb à 450 0C. Le zinc condensé forme un alliage qui est envoyé dans un système de refroidissement où il se sépare en deux phases, l’une riche en plomb qui est recyclée dans le condenseur, l’autre riche en zinc contenant de 1,50 à 2 p. 100 de plomb. Ce zinc impur doit être raffiné avant son utilisation.
Ce type de four peut traiter des minerais mixtes zinc-plomb.
Extraction par voie humide
L’oxyde de zinc contenu dans le minerai grillé est mis en solution par l’acide sulfurique. La solution est neutralisée, purifiée, puis électrolysée. Le zinc se dépose sur les cathodes, et l’acide sulfurique est régénéré:
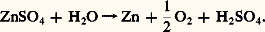
Si le principe paraît simple, l’application industrielle est complexe, car il est nécessaire, d’une part, d’obtenir une très bonne solubilisation de l’oxyde de zinc et, d’autre part, d’avoir une solution de sulfate de zinc très pure afin de ne pas perturber les phénomènes d’électrolyse.
Le minerai grillé et broyé subit successivement une «lixiviation neutre», puis une «lixiviation acide». La solution neutre obtenue est soumise à une série de purifications, en particulier par cémentation à l’aide de poudre de zinc qui élimine les impuretés plus électropositives (plomb, cadmium, cuivre, etc.). Des précautions spéciales sont prises pour éliminer le cobalt et le nickel. L’opération d’électrolyse se fait dans des cuves rectangulaires de béton doublées en plomb. Les cathodes sont en aluminium et les anodes en plomb argentifère. La tension aux bornes est de 3,2 à 3,6 V et la densité de courant de l’ordre de 4 A/dm2. Le dépôt de zinc obtenu est en général très pur (99,95 ou 99,993 p. 100). Des progrès considérables ont été réalisés, qui permettent à ce procédé d’être actuellement le plus valable techniquement et économiquement.
Raffinage du zinc
Le raffinage par liquation limite la teneur en plomb et en fer des zincs thermiques. Le bas point d’ébullition du zinc par rapport à ceux de ses impuretés rend possible la purification du métal par distillation. Le procédé le plus répandu est celui de la New Jersey Company, qui utilise des colonnes à plateaux en carbure de silicium (cf. MÉTALLURGIE - Métallurgie extractive, fig. 8). Ce procédé comporte deux phases: distillation de la plus grande partie du zinc, ce qui le sépare des impuretés moins volatiles (surtout le plomb), puis envoi du zinc obtenu dans une autre colonne, où il est recueilli pour être lingoté. Il permet d’obtenir un zinc extra-pur titrant jusqu’à 99,993.
2. Propriétés
Les principales caractéristiques physiques du zinc sont fournies dans le tableau. Le zinc cristallise dans le système hexagonal compact (a = 0,2660 nm, c = 0,4937 nm). Les isotopes stables qui composent le zinc sont: 64Zn (48,9 p. 100), 66Zn (27,8 p. 100), 67Zn (4,1 p. 100), 68Zn (18,6 p. 100), 70Zn (0,5 p. 100).
Le coefficient de dilatation à l’état laminé est égal à 0,22 憐 10 size=1漣4 par degré Celsius entre 28 et 100 0C dans la direction de laminage. Les caractéristiques mécaniques dépendent fortement de la composition du zinc et des conditions de laminage. Par exemple, un zinc pur titrant 99,99 laminé a une résistance mécanique R égale à 11 mégapascals (MPa), tandis qu’un zinc laminé contenant de faibles quantités de cuivre et de titane donne R = 16,5 MPa.
Le zinc est l’élément le plus léger du sous-groupe II b du tableau périodique des éléments. Ce groupe est caractérisé par deux électrons s sur la couche externe.
En solution ainsi que dans ses composés, le zinc se trouve toujours à l’état d’oxydation + 2. Dans certaines combinaisons chimiques comme le sulfure, le séléniure, le tellure et l’oxyde, la liaison est à prédominance covalente.
L’hydrogène ne réagit pas. À la température ordinaire, le zinc n’est pas perméable à l’hydrogène.
À la température ordinaire et en atmosphère sèche, l’oxygène ne semble pas attaquer le zinc. En fait, il se forme rapidement une très mince pellicule dont l’épaisseur ne dépasse pas quelques dixièmes de nanomètre. Cette pellicule a l’orientation du métal sous-jacent. La vitesse d’oxydation du zinc commence à devenir sensible pour une température de 225 0C.
Le zinc en poudre s’oxyde plus rapidement; humide, il peut s’enflammer spontanément, alors que, sec, il est sans danger.
Dans l’air humide, le zinc réagit plus facilement. Il se couvre généralement d’une couche de carbonate basique qui, dans les conditions atmosphériques normales, le protège d’une oxydation ultérieure.
La composition de la couche dépend du milieu environnant. Elle contient des oxychlorures dans le cas d’atmosphère marine, ou des sulfates et sulfites basiques dans le cas des atmosphères urbaines et industrielles. Le stade initial de l’attaque est la formation d’oxyde et d’hydroxyde qui se transforment en carbonate. Lorsque la couche est formée, la vitesse d’oxydation du zinc est commandée par la vitesse de diffusion de l’oxygène et de la vapeur d’eau; elle est donc fonction de l’épaisseur de la couche. La vitesse d’oxydation dépend de la nature de l’atmosphère et de la présence de produits pouvant attaquer et solubiliser la couche de protection. Par exemple, en atmosphère rurale, climat de l’Île-de-France, la vitesse de corrosion du zinc est d’environ 1 micromètre par an; en atmosphère urbaine parisienne, elle est de 4 micromètres par an; dans le cas d’atmosphère polluée par des gaz industriels, elle peut atteindre 10 micromètres par an.
L’eau, et en particulier l’eau pure dégazée, attaque normalement le zinc avec formation d’oxyde ou d’hydroxyde. Cette attaque n’est pas négligeable, car les produits de corrosion ne constituent pas une couche homogène et protectrice. Lorsque l’eau contient de l’anhydride carbonique en solution, le métal se recouvre d’une couche de carbonate basique beaucoup plus compacte et adhérente qui apporte une bonne protection. La vitesse de corrosion du zinc par l’eau naturelle augmente lentement jusqu’à 60 0C, et rapidement de 60 à 80 0C; elle diminue ensuite. Il semble que la nature des produits de corrosion, donc de la protection apportée par la couche, change aux environs de 60 0C.
La présence d’impuretés dans le zinc influe peu sur la vitesse de corrosion, aussi bien dans l’eau que dans l’atmosphère. La présence simultanée, même en faible quantité, de plomb et d’aluminium peut cependant provoquer une corrosion intercristalline très rapide.
À froid et en l’absence d’humidité, les halogènes réagissent peu, et de moins en moins en allant du fluor à l’iode. En présence d’humidité, l’action est un peu plus rapide; il faut cependant chauffer à haute température pour obtenir une réaction violente avec le chlore.
En milieu non oxydant, les acides attaquent le zinc à une vitesse qui dépend de la pureté du zinc. Certaines impuretés, comme le plomb, le cadmium, le mercure, l’indium, jouent le rôle d’inhibiteur; d’autres, comme le fer, le nickel, le cobalt, même à l’état de très faibles traces, provoquent une très forte accélération de l’attaque. Par exemple, une teneur en cobalt de 1 g/t a déjà un effet marqué. Cette action peut être expliquée par le fait que les impuretés diminuent fortement la surtension de l’hydrogène sur le zinc (ces impuretés catalysent la réaction: 2 H[atomique] 燎 H size=1糧2 [moléculaire]). Ces mêmes éléments jouent un rôle identique lorsqu’ils sont sous forme d’ions en solution dans l’acide. De nombreuses substances organiques, en particulier la gélatine, jouent le rôle d’inhibiteur. L’acide nitrique attaque le zinc quelle que soit sa pureté. L’acide chromique pur provoque la formation d’un film de chromate; cette propriété est utilisée comme moyen de protection temporaire du zinc ou de revêtements en zinc. En présence d’ions sulfates, l’acide chromique attaque le zinc en lui donnant une surface polie et brillante. L’acide phosphorique, dans certaines conditions, forme une couche d’orthophosphate cristallisé qui protège le métal et peut servir de base d’accrochage pour les peintures.
La soude et la potasse en solution concentrée à l’ébullition attaquent le zinc avec formation de zincate et dégagement d’hydrogène selon la réaction du type:

D’autre part, un mélange de fleur de soufre et de zinc en poudre détone au choc avec formation de sulfure.
3. Utilisations du métal
Les applications du zinc métal se divisent en quatre groupes principaux: protection des aciers, fonderie, obtention d’alliages cuivreux et usages du zinc laminé.
Protection anticorrosion des aciers
L’utilisation du zinc dans la protection contre la corrosion des aciers est fondée sur deux de ses propriétés:
– son potentiel électrochimique par rapport à l’électrode à hydrogène est de 漣 0,74 V, alors que celui du fer est de 漣 0,44 V; la pile zincer fonctionne avec dissolution du zinc et, dans ces conditions, un revêtement même discontinu de zinc sera protecteur [cf. CORROSION];
– le zinc se corrode à l’atmosphère ou dans des milieux dont le pH est compris entre 5,5 et 13, avec formation d’un film protecteur, généralement un carbonate basique bien adhérent; ce film limite la vitesse d’attaque du zinc et permet de rendre économique la protection du fer; les différents procédés varient selon la mise en œuvre du revêtement.
La galvanisation à chaud consiste à recouvrir l’acier par immersion dans un bain de zinc fondu. La surface de l’acier, convenablement préparée (décapage, fluxage, séchage), est attaquée par le zinc avec formation de composés intermétalliques zinc-fer. Lorsqu’on retire la pièce du bain, le zinc fondu retenu par capillarité par la couche zinc-fer se solidifie à l’air et constitue une couche externe de zinc pur. Il existe aussi un procédé en continu (Sendzimir). En plein développement, la galvanisation est vraisemblablement le meilleur système de protection de l’acier contre la corrosion atmosphérique.
La métallisation au pistolet (procédé Schoop ou Schori) consiste à déposer une couche de zinc sur une surface d’acier convenablement préparée (sablage ou grenaillage), en projetant du zinc fondu à l’aide d’un pistolet spécial. Le zinc utilisé peut être sous forme de fil ou de poudre.
Dans le zingage électrolytique , on dépose une couche de zinc par électrolyse d’un sel de zinc en solution. Ce procédé laisse une couche de métal pur dont l’épaisseur dépasse rarement 25 micromètres. Il convient bien aux revêtements complémentaires, par peinture ou plastification.
La shérardisation s’effectue par diffusion à chaud de poudre de zinc à la surface d’une pièce d’acier. Le revêtement est constitué uniquement de composés zinc-fer. Ce procédé est surtout utilisé pour de petites pièces (boulons, raccords, etc.).
La matoplastie consiste à traiter des pièces diverses de mécanique ou quincaillerie, boulonnerie, visserie, colliers, crochets, etc., placées dans un tonneau rotatif en présence de poudre de zinc, de billes de verre et d’un «promoteur» chimique pour faciliter l’accrochage du zinc par action mécanique.
Le zinc en poudre très fine peut être utilisé comme pigment dans les peintures antirouille , dites «peintures riches en zinc». Le film sec obtenu doit contenir au moins 80 p. 100 de zinc (peintures à base de silicates) ou 88 p. 100 de zinc (peintures à base de liants organiques). Ces peintures sont utilisées pour la protection des gros ouvrages en acier (charpentes, ponts, coques de navires, etc.).
La protection cathodique est utilisée pour les coques de navire ou les conduites enterrées (pipeline, etc.).
Les alliages de zinc
Les alliages de zinc sont surtout employés en fonderie sous pression. Les principaux sont les zamaks, qui contiennent 4 p. 100 d’aluminium, 0,04 p. 100 de magnésium et 1 p. 100 de cuivre ou pas du tout. Ces alliages sont caractérisés par un point de fusion relativement bas (385 0C), une coulabilité excellente et une agressivité faible vis-à-vis de l’acier, ce qui permet d’obtenir de 200 000 à 400 000 pièces avec le même moule. Leurs propriétés mécaniques sont excellentes et permettent une multitude d’applications. Ces alliages se prêtent particulièrement aux traitements de surface par galvanoplastie.
Le zinc entre pour 10 à 40 p. 100 dans la composition des laitons, des maillechorts et de certains alliages d’aluminium (Zicral).
Le zinc laminé est utilisé pour la couverture et la fabrication d’accessoires pour le bâtiment. Cet emploi est fondé sur deux propriétés: la facilité de travail du zinc laminé (formage, pliage, soudure) et sa très bonne résistance à la corrosion atmosphérique (certaines toitures ont plus de cent ans).
4. Les composés du zinc
Les composés du zinc ayant une importance industrielle sont l’oxyde, le chlorure, le sulfure et le sulfate.
L’oxyde est préparé par deux procédés: dans le procédé américain, on brûle les vapeurs de zinc produites par la réduction du minerai par le charbon, ce qui fournit un composé relativement impur; dans le procédé français, on brûle des vapeurs venant de la distillation de zinc métallique. Avec des vapeurs provenant de la distillation fractionnée, on obtient de l’oxyde extra-pur.
Actuellement, le marché principal des oxydes de zinc (ZnO) est le caoutchouc. ZnO est un agent indispensable dans le processus de vulcanisation. À côté de cette utilisation, qui regroupe plus de 40 p. 100 du tonnage utilisé dans le monde, il existe toutes sortes d’autres applications très diverses: la céramique (ZnO est un fondant), la chimie (ZnO intervient dans la désulfuration des gaz), la pharmacie (ZnO est utilisé dans tous les problèmes de peau pour ses propriétés fongicides), l’alimentation animale (comme oligo-éléments), l’électronique (ferrites et varistances) et la peinture (les niches qui restent dans ce marché) pour ne citer que les principales.
Le chlorure est préparé par dissolution du métal ou de l’oxyde dans l’acide chlorhydrique. On emploie pour cela des déchets de la galvanisation. Ce sel est très soluble dans l’eau: à 25 0C, 100 g de solution en contiennent 81,1 g. Le chlorure anhydre est très hygroscopique. Ces sels sont principalement utilisés comme flux de galvanisation, comme composant de l’électrolyte des piles sèches type Leclanché, pour le traitement des bois et comme matière première en chimie organique.
Le sulfure est fabriqué soit par réaction à chaud du soufre sur le zinc, soit par précipitation d’une solution de sel de zinc par l’hydrogène sulfuré à un pH convenable. C’est un sel blanc qui entre dans la fabrication des «lithopones», pigments pour peintures constitués d’un mélange de sulfure de zinc et de sulfate de baryum. Les propriétés luminescentes de ce sel ont trouvé quelques applications.
Le sulfate est fabriqué par attaque de minerais grillés ou d’oxydes par l’acide sulfurique. Après neutralisation et purification, il est cristallisé par évaporation. Ce sel existe anhydre ou cristallisé avec sept, six ou une molécule d’eau. On l’utilise dans la fabrication de la viscose et en agriculture (addition dans l’alimentation animale, pulvérisation des végétaux).
zinc [ zɛ̃g ] n. m.
• 1762; zinch 1666; var. zain, zin, zinckXVIIe-XVIIIe; all. Zink
1 ♦ Corps simple (Zn; no at. 30; m. at. 65,37), métal dur d'un blanc bleuâtre, qu'on trouve dans la nature sous forme de blende, de calamine, de smithsonite, etc. Alliages de zinc. ⇒ argentan, chrysocale, laiton, maillechort, pacfung, tombac; galvanisation. Tuyaux en zinc. Comptoir de zinc. — Pommade à l'oxyde de zinc (antiseptique). Alliages de zinc. ⇒ zamak.
2 ♦ (1873) Fam. Comptoir d'un débit de boissons. « Tu es debout devant le zinc d'un bar crapuleux » (Apollinaire). Boire une bière sur le zinc.
♢ Fam. Par ext. Petit café, petit bar. ⇒ bistrot, 2. rade. « Le zinc du canal ouvrait juste avant le petit jour » (Céline).
3 ♦ (1916) Fam. Avion (notamment d'un modèle ancien, périmé). « Un zinc militaire a atterri là il y a quinze jours » (Sartre).
● zinc nom masculin (allemand Zink) Métal blanc bleuâtre, peu altérable, susceptible d'un beau poli. (Élément chimique de symbole Zn.) Numéro atomique : 30 Masse atomique : 65,37 Masse volumique : 7,14 g°cm3 Température de fusion : 419 °C Température d'ébullition : 907 °C Familier. Comptoir d'un débitant de boissons. Familier. Petit café, petit bar. Familier. Avion. ● zinc (difficultés) nom masculin (allemand Zink) Prononciation Le c final se prononce [&ph91;] comme pour rimer avec dingue. Remarque Les dérivés de zinc appartenant au vocabulaire courant s'écrivent avec un g : zinguer, zingueur. Les dérivés appartenant au vocabulaire scientifique s'écrivent avec un c : zincate, zincifère.
zinc
n. m.
d1./d élément métallique (symbole Zn) de numéro atomique Z = 30.
— Métal (Zn).
d2./d Fam. Comptoir d'un débit de boissons. Boire un coup sur le zinc.
⇒ZINC, subst. masc.
A. — 1. CHIM., MINÉR. Métal brillant, d'un blanc bleuâtre, ductile et malléable (symb. Zn, n° atomique 30), que l'on trouve dans la nature sous diverses formes et qui connaît de nombreux emplois. Zinc carbonaté, oxydé, silicaté, sulfuré; chlorure, oxyde, sulfate, sulfure de zinc; minerais, sels de zinc; composé de zinc; extraction, laminage du zinc; fonderie, mine de zinc. Le maillechort ou argent allemand est un alliage de cuivre, de zinc et de nickel (H. FONTAINE, Électrolyse, 1885, p. 172). La métallurgie du zinc est une très grosse consommatrice de charbon (GUILLET, Techn. métall., 1944, p. 64).
— PEINT. Blanc de zinc. Oxyde de zinc utilisé comme pigment. Depuis 1901, le blanc de zinc a remplacé la céruse dans la peinture des bâtiments administratifs (MACAIGNE, Précis hyg., 1911, p. 315).
2. BIOCHIM. Ce corps, en tant qu'oligo-élément contenu dans les organismes vivants, les aliments ou dans certains médicaments. Carence en zinc; manquer de zinc. Le besoin en d'autres éléments, comme le zinc, le magnésium, le cuivre, le manganèse, le cobalt et le fluor, a été très délicat à établir, en partie à cause de la difficulté de préparer des régimes dépourvus de ces éléments (Hist. gén. sc., t. 3, vol. 2, 1964, p. 444).
B. — 1. Ce métal en tant que matériau travaillé. Plaque de zinc; baignoire, bassine, chéneau, marquise, seau, tuyau de/en zinc. Des toits de zinc plus blancs que des lacs (RENARD, Journal, 1887, p. 11). V. bronze ex. 7, feuille ex. 8.
♦ Zinc d'art. Zinc coulé dont on fait des statuettes, des objets décoratifs présentant l'aspect des bronzes artistiques. M. Fagerolles, le père, fabricant de zinc d'art, avait ses ateliers au rez-de-chaussée (ZOLA, L'Œuvre, 1886, p. 65). Zinc d'ornement. ,,Zinc qui remplace le plomb dans l'ornementation des parties supérieures des toits de certains édifices`` (Nouv. Lar. ill.-Lar. Lang. fr.).
2. P. méton.
a) Feuille de zinc; objet en zinc. Temps épouvantable, zinc emporté du toit de la terrasse (MICHELET, Journal, 1820, p. 119). Les faux marbres et les zincs dorés du vestibule (ZOLA, Pot-Bouille, 1882, p. 254).
b) En partic.
— Pop., fam.
♦ Comptoir recouvert généralement de zinc, d'un débit de boisson; p. méton., débit de boisson. Boire sur le zinc; s'accouder au zinc; trôner derrière le zinc. Le zinc du canal ouvrait juste avant le petit jour à cause des bateliers (CÉLINE, Voyage, 1932, p. 621). Les coups de blanc sur des zincs luisant comme des rails (FARGUE, Piéton Paris, 1939, p. 27).
♦ Avion. Il avait une confiance quasi mystique en son organisme, comme l'aviateur en son zinc qui tangue, comme le capitaine en son rafiot, roulant, prenant l'eau, mais qui toujours arrive au port (MONTHERL., Lépreuses, 1939, p. 1444). Le zinc sera sur la piste et prêt à partir (SARTRE, Mort ds âme, 1949, p. 52).
— Arg., vx. Menue monnaie de métal. Synon. ferraille (fam.), mitraille (pop., fam.). J'ai du zinc dans ma profonde, nous pouvons aller de l'avant (VIRMAITRE, Dict. arg. fin-de-s., 1894, p. 322). P. ext. Argent. Synon. monnaie (v. ce mot D). Si vous payez tous les jours vos ouvriers, (...) le soir le zinc chaufferait la poche, ils prendraient la cuite (POULOT, Sublime, 1870, p. 310).
c) ARTS GRAPH. Cliché en zinc utilisé en zincographie ou en photozincographie. Les impressions sur pierre sont plus nourries que celles exécutées sur zinc. Le tirage sur zinc est plus délicat (Civilis. écr., 1939, p. 10-6). V. photogravure ex. de É. Leclerc.
C. — P. anal. ou au fig.
1. Loc. adj.
a) De zinc. Qui rappelle l'aspect, la rigidité ou la sonorité du zinc. Saint-Victor, devenu positivement fou furieux, se met à hurler, avec sa voix de zinc (GONCOURT, Journal, 1866, p. 294). Les uns se moquaient de ce « col de zinc » que je portais comme un Monsieur, les autres me traitaient avec trop de considération (GUÉHENNO, Journal homme 40 ans, 1934, p. 141).
b) En zinc. En toc. Les Sœurs Vatard, de Huysmans, c'est du Zola en zinc, du naturalisme en toc (RENARD, Journal, 1889, p. 23).
2. Loc. verb., vx. Avoir du zinc. Arg. du théâtre. Avoir une voix bien timbrée (d'apr. FRANCE 1907). Pop. Avoir du chien. V. chien1 III G 1 ex. de Mérimée.
Prononc. et Orth.: [ ]. LITTRÉ [
]. LITTRÉ [ ]; PASSY 1914 [-k], [-g]; BARBEAU-RODHE 1930 [-g], rarement [-k]. Att. ds Ac. dep. 1762. Étymol. et Hist. 1. 1666 zinch (THÉVENOT, Relations de divers voyages curieux, t. 2, p. 26); 1676 zain, zin (FÉLIBIEN, p. 780); 1701 zinck (FUR.); 1762 zinc (Ac.); 2. a) 1873 « comptoir sur lequel on sert les consommateurs, dans les bars, les cafés » (ZOLA, Ventre Paris, p. 749); b) 1880 « débit de boissons » (HUYSMANS, Sac au dos, p. 199 ds CRESSOT, Phrase et vocab. Huysmans, 1938, p. 418); 3. 1916 « avion » (SEM, Journ., 27 mai ds ESN. Poilu 1919). Empr. à l'all. Zink, au sens 1. Fréq. abs. littér.:313. Fréq. rel. littér.:XIXe s.: a) 59, b) 698; XXe s.: a) 685, b) 493.
]; PASSY 1914 [-k], [-g]; BARBEAU-RODHE 1930 [-g], rarement [-k]. Att. ds Ac. dep. 1762. Étymol. et Hist. 1. 1666 zinch (THÉVENOT, Relations de divers voyages curieux, t. 2, p. 26); 1676 zain, zin (FÉLIBIEN, p. 780); 1701 zinck (FUR.); 1762 zinc (Ac.); 2. a) 1873 « comptoir sur lequel on sert les consommateurs, dans les bars, les cafés » (ZOLA, Ventre Paris, p. 749); b) 1880 « débit de boissons » (HUYSMANS, Sac au dos, p. 199 ds CRESSOT, Phrase et vocab. Huysmans, 1938, p. 418); 3. 1916 « avion » (SEM, Journ., 27 mai ds ESN. Poilu 1919). Empr. à l'all. Zink, au sens 1. Fréq. abs. littér.:313. Fréq. rel. littér.:XIXe s.: a) 59, b) 698; XXe s.: a) 685, b) 493.
 ]. LITTRÉ [
]. LITTRÉ [ ]; PASSY 1914 [-k], [-g]; BARBEAU-RODHE 1930 [-g], rarement [-k]. Att. ds Ac. dep. 1762. Étymol. et Hist. 1. 1666 zinch (THÉVENOT, Relations de divers voyages curieux, t. 2, p. 26); 1676 zain, zin (FÉLIBIEN, p. 780); 1701 zinck (FUR.); 1762 zinc (Ac.); 2. a) 1873 « comptoir sur lequel on sert les consommateurs, dans les bars, les cafés » (ZOLA, Ventre Paris, p. 749); b) 1880 « débit de boissons » (HUYSMANS, Sac au dos, p. 199 ds CRESSOT, Phrase et vocab. Huysmans, 1938, p. 418); 3. 1916 « avion » (SEM, Journ., 27 mai ds ESN. Poilu 1919). Empr. à l'all. Zink, au sens 1. Fréq. abs. littér.:313. Fréq. rel. littér.:XIXe s.: a) 59, b) 698; XXe s.: a) 685, b) 493.
]; PASSY 1914 [-k], [-g]; BARBEAU-RODHE 1930 [-g], rarement [-k]. Att. ds Ac. dep. 1762. Étymol. et Hist. 1. 1666 zinch (THÉVENOT, Relations de divers voyages curieux, t. 2, p. 26); 1676 zain, zin (FÉLIBIEN, p. 780); 1701 zinck (FUR.); 1762 zinc (Ac.); 2. a) 1873 « comptoir sur lequel on sert les consommateurs, dans les bars, les cafés » (ZOLA, Ventre Paris, p. 749); b) 1880 « débit de boissons » (HUYSMANS, Sac au dos, p. 199 ds CRESSOT, Phrase et vocab. Huysmans, 1938, p. 418); 3. 1916 « avion » (SEM, Journ., 27 mai ds ESN. Poilu 1919). Empr. à l'all. Zink, au sens 1. Fréq. abs. littér.:313. Fréq. rel. littér.:XIXe s.: a) 59, b) 698; XXe s.: a) 685, b) 493.DÉR. 1. Zincite, subst. fém., chim., minér. Oxyde naturel de zinc, de formule ZnO, appartenant au système hexagonal. La zincite ou oxyde de zinc coloré en rouge par un peu de manganèse (WURTZ, Dict. chim., t. 3, 1878, p. 754). — [ ]. — 1re attest. 1849 (Hist. nat. t. 13, p. 354a, s.v. zinc); de zinc, suff. -ite. 2. Zincosite, subst. fém., chim., minér. Sulfate naturel de zinc se présentant sous la forme de petits cristaux jaunâtres. Un sulfate anhydre de zinc, la zincosite (...), a été rencontré, en très petits cristaux jaunâtres, dans la Sierra Almagrera (Espagne) (LAPPARENT, Minér., 1899, p. 578). — [
]. — 1re attest. 1849 (Hist. nat. t. 13, p. 354a, s.v. zinc); de zinc, suff. -ite. 2. Zincosite, subst. fém., chim., minér. Sulfate naturel de zinc se présentant sous la forme de petits cristaux jaunâtres. Un sulfate anhydre de zinc, la zincosite (...), a été rencontré, en très petits cristaux jaunâtres, dans la Sierra Almagrera (Espagne) (LAPPARENT, Minér., 1899, p. 578). — [ ]. — 1re attest. 1892 (GUÉRIN); de zinc, suff. -(os)ite. 3. Zinguerie, subst. fém. a) Fabrication, travail ou commerce du zinc. (Dict. XIXe et XXe s.). b) Usine où l'on fabrique le zinc; atelier où l'on travaille le zinc. V. plomberie B 2 ex. de Cendrars. c) [Avec valeur de coll.] Articles en zinc; en partic., ensemble des éléments en zinc (ou revêtus de zinc) d'un bâtiment. (Dict. XXe s.). — [
]. — 1re attest. 1892 (GUÉRIN); de zinc, suff. -(os)ite. 3. Zinguerie, subst. fém. a) Fabrication, travail ou commerce du zinc. (Dict. XIXe et XXe s.). b) Usine où l'on fabrique le zinc; atelier où l'on travaille le zinc. V. plomberie B 2 ex. de Cendrars. c) [Avec valeur de coll.] Articles en zinc; en partic., ensemble des éléments en zinc (ou revêtus de zinc) d'un bâtiment. (Dict. XXe s.). — [ ]. — 1res attest. a) 1845 « métallurgie, commerce du zinc » (BESCH.), b) 1845 « établissement où l'on élabore, où l'on traite le zinc » (ibid.), c) 1904 « ensemble d'objets en zinc » (Nouv. Lar. ill.); de zinc, suff. -erie.
]. — 1res attest. a) 1845 « métallurgie, commerce du zinc » (BESCH.), b) 1845 « établissement où l'on élabore, où l'on traite le zinc » (ibid.), c) 1904 « ensemble d'objets en zinc » (Nouv. Lar. ill.); de zinc, suff. -erie.
 ]. — 1re attest. 1849 (Hist. nat. t. 13, p. 354a, s.v. zinc); de zinc, suff. -ite. 2. Zincosite, subst. fém., chim., minér. Sulfate naturel de zinc se présentant sous la forme de petits cristaux jaunâtres. Un sulfate anhydre de zinc, la zincosite (...), a été rencontré, en très petits cristaux jaunâtres, dans la Sierra Almagrera (Espagne) (LAPPARENT, Minér., 1899, p. 578). — [
]. — 1re attest. 1849 (Hist. nat. t. 13, p. 354a, s.v. zinc); de zinc, suff. -ite. 2. Zincosite, subst. fém., chim., minér. Sulfate naturel de zinc se présentant sous la forme de petits cristaux jaunâtres. Un sulfate anhydre de zinc, la zincosite (...), a été rencontré, en très petits cristaux jaunâtres, dans la Sierra Almagrera (Espagne) (LAPPARENT, Minér., 1899, p. 578). — [ ]. — 1re attest. 1892 (GUÉRIN); de zinc, suff. -(os)ite. 3. Zinguerie, subst. fém. a) Fabrication, travail ou commerce du zinc. (Dict. XIXe et XXe s.). b) Usine où l'on fabrique le zinc; atelier où l'on travaille le zinc. V. plomberie B 2 ex. de Cendrars. c) [Avec valeur de coll.] Articles en zinc; en partic., ensemble des éléments en zinc (ou revêtus de zinc) d'un bâtiment. (Dict. XXe s.). — [
]. — 1re attest. 1892 (GUÉRIN); de zinc, suff. -(os)ite. 3. Zinguerie, subst. fém. a) Fabrication, travail ou commerce du zinc. (Dict. XIXe et XXe s.). b) Usine où l'on fabrique le zinc; atelier où l'on travaille le zinc. V. plomberie B 2 ex. de Cendrars. c) [Avec valeur de coll.] Articles en zinc; en partic., ensemble des éléments en zinc (ou revêtus de zinc) d'un bâtiment. (Dict. XXe s.). — [ ]. — 1res attest. a) 1845 « métallurgie, commerce du zinc » (BESCH.), b) 1845 « établissement où l'on élabore, où l'on traite le zinc » (ibid.), c) 1904 « ensemble d'objets en zinc » (Nouv. Lar. ill.); de zinc, suff. -erie.
]. — 1res attest. a) 1845 « métallurgie, commerce du zinc » (BESCH.), b) 1845 « établissement où l'on élabore, où l'on traite le zinc » (ibid.), c) 1904 « ensemble d'objets en zinc » (Nouv. Lar. ill.); de zinc, suff. -erie.BBG. — BLOCHW.-RUNK. 1971, p. 346. — BOULAN 1934, p. 175. — KLEIN Vie paris. 1976, pp. 165-166. — QUEM. DDL t. 5, 16, 17, 31.
zinc [zɛ̃g] n. m.
ÉTYM. 1762; zinch, 1666; var. zain, zin, zinck, XVIIe-XVIIIe; all. Zink « zinc », orig. incert.; selon Bloch-Wartburg, de Zinken « fourchon », à cause de la forme du minerai à la sortie des fourneaux; ce nom a été donné au métal par confusion avec Zinn « étain »; on appelait le zinc « étain des Indes » (Von Lohneyss, 1690).
❖
1 Corps simple (symb. Zn; no at. 30; masse at. 65,37), métal dur d'un blanc bleuâtre, assez fragile à la température ordinaire, qui fond à 419 °C, bout à 907 °C, de densité 7,14; on le trouve dans la nature sous forme de blende (sulfure, ZnS), de calamine (silicate pouvant renfermer du carbonate), de smithsonite (carbonate), etc. || Minerai qui renferme du zinc (⇒ Zincifère). || On extrait le zinc de la blende par grillage, puis réduction de l'oxyde formé par l'oxyde de carbone. Composés du zinc : sulfate de zinc (alchimie : couperose blanche, vitriol blanc). || Les sels de zinc ont des propriétés antiseptiques ou désinfectantes (chlorure par exemple); ils peuvent provoquer des empoisonnements. || Oxyde de zinc (zincite naturelle) utilisé sous le nom de blanc de zinc comme pigment en peinture. || Alliages de zinc : laitons (cuivre-zinc), tombac; alliages blancs : maillechort, argentan, pacfung; alliages légers (aluminium-zinc et aluminium-magnésium-zinc). || Alliage de zinc et de cuivre ou d'étain. ⇒ Chrysocale. || Opérations effectuées sur le zinc. ⇒ Galvanisation (galvaniser), moirage. || Feuille de zinc (→ Photolithographie, cit. 2), employée en zincographie. || Objets en zinc. || Tuyaux (→ Gouttière, cit. 4), chéneau, toiture, marquise (cit. 2), baignoire en zinc. || Candélabres de zinc (→ Jouer, cit. 71). || Comptoir (cit. 1) de zinc.
1 (…) tout là-haut, dans le ciel clair, l'ouvrier taillait tranquillement son zinc à coups de cisaille, penché sur l'établi, pareil à un tailleur coupant chez lui une paire de culottes.
Zola, l'Assommoir, t. I, IV, p. 141.
➪ tableau Noms de remèdes.
2 Fam. Comptoir (d'un débit de boissons). || Boire sur le zinc, vider un verre sur le (au) zinc, debout au comptoir, au bar.
2 Tu es debout devant le zinc d'un bar crapuleux
Tu prends un café à deux sous parmi les malheureux
Apollinaire, Alcools, « Zone ».
2.1 Nous vidâmes un verre sur le zinc (…)
— Entre nous, y a longtemps que la Bolée n'a été aussi vide ! Personne ici… personne en bas.
J'ferais mieux d'aller me coucher.
Francis Carco, Nostalgie de Paris, p. 177.
♦ Par ext., fam. Café, bar. || Un caboulot ou un zinc (→ Café, cit. 5). || Un petit zinc. ⇒ Bistrot, rade.
3 Le zinc du canal ouvrait juste avant le petit jour à cause des bateliers. L'écluse commence à pivoter lentement sur la fin de la nuit.
Céline, Voyage au bout de la nuit, p. 453.
3.1 — Si l'aviation volante manque d'appareils, l'aviation parlante ne manque point de phrases, ni l'aviation trafiquante de combines (…) Nous instruisons les recrues sur des zincs pour baptême de l'air. Il faudrait cent fois plus de moteurs et de carlingues.
Pierre Hamp, la Peine des hommes (Moteurs), p. 252.
4 — Près de Marignane, il y a un petit aérodrome privé, entre deux collines. Un zinc militaire a atterri là il y a quinze jours parce qu'il était mal en point.
Sartre, la Mort dans l'âme, p. 179.
❖
DÉR. et COMP. Zincage, zincifère, zincique, zincite, zincographie, zincogravure, zincose, zincosite, zinguer, zinguerie.
Encyclopédie Universelle. 2012.