TRANSURANIENS
Jusqu’en 1940, l’élément chimique le plus lourd connu était l’uranium. On le trouve dans divers minerais, en particulier dans la pechblende (U38). L’abondance de cet élément dans l’écorce terrestre est estimée à 4 憐 10–4 p. 100. Le numéro atomique de l’uranium est 92, ce qui signifie que chaque atome contient 92 électrons. Les noyaux d’uranium sont radioactifs , et leur demi-vie est très longue, approximativement égale à l’âge de la Terre [cf. RADIOCHIMIE]. Par conséquent, une quantité appréciable de ces noyaux subsiste encore.
Les 91 éléments qui précèdent l’uranium sont tous connus, et la plupart d’entre eux ont à la fois des isotopes stables et des isotopes radioactifs. Seuls les plus lourds ne possèdent que des isotopes radioactifs, par exemple le radium. On a pensé que l’uranium était le plus lourd de tous les éléments naturels et qu’aucun atome de numéro atomique supérieur à 92 n’existait dans la nature. Mais, après la découverte des transmutations artificielles, c’est-à-dire de moyens de transformer un noyau en un autre, il est apparu que la synthèse de nouveaux noyaux devenait possible. On pouvait donc imaginer qu’en partant d’éléments naturels on fabriquerait des atomes de numéro atomique Z supérieur à 92. Le tableau périodique des éléments n’était donc pas a priori arrêté au 92e élément, et l’homme entreprenait de franchir les limites de la synthèse naturelle. De fait, grâce aux méthodes de synthèse de la chimie nucléaire depuis 1940, dix-neuf nouveaux éléments situés au-delà de Z = 92 ont été créés. Il n’est pas impossible que l’un d’eux, le plutonium, existe en très faible proportion dans certains gisements de terres rares, et que certaines étoiles plus jeunes que le système solaire contiennent quelques noyaux de Z voisin de 94 ou 95. Mais, en tout cas, dix-neuf nouveaux types d’atomes de Z allant de 93 à 111 ont été fabriqués dans les laboratoires nucléaires en quantité suffisante pour y être étudiés. Le plus important est le plutonium, le premier élément synthétique produit en grande quantité par l’homme (plusieurs tonnes actuellement). Son apparition constitue probablement pour l’évolution des civilisations une étape aussi importante que la mise au point de la métallurgie du fer et présente aussi les mêmes aspects de libération de l’humanité et d’aggravation de ses possibilités d’autodestruction [cf. PLUTONIUM]. La radioactivité de ces éléments rend leur étude et leur utilisation délicates. De très grandes précautions doivent être prises, et leur production à grande échelle pose des problèmes délicats.
Pour chacun des éléments transuraniens, de nombreux isotopes sont déjà connus. Tous sont radioactifs et se caractérisent par des périodes allant de quelques millions d’années pour les plus proches de l’uranium à des fractions de seconde pour les transuraniens lointains. L’étude de leurs propriétés chimiques est un des chapitres les plus vivants de la chimie moderne en raison de leur place dans le tableau périodique et de la structure particulière des couches électroniques les plus externes.
Dans le tableau 1, on trouvera les noms des dix-neuf éléments transuraniens, pour lesquels on a en outre mentionné l’isotope de durée de vie la plus longue connue jusqu’ici. Les éléments 93 à 101 ont tous été découverts à Berkeley (États-Unis). De 102 à 106, des synthèses ont été faites à Berkeley et à Dubna (ex-U.R.S.S.), au moyen de faisceaux d’ions lourds et de cibles de plutonium, de curium et de californium que ces laboratoires étaient les seuls à posséder. De très fortes controverses ont eu lieu de 1956 à 1970 sur la priorité des découvertes, surtout pour 104 et 105. Un groupe de scientifiques a été nommé par les Unions internationales de physique et de chimie pour faire l’historique du déroulement des travaux sur les transfermiens (Z 礪 100). Après ses conclusions en 1992, les discussions finirent par aboutir à des propositions de noms pour tous les éléments de 104 à 109. Le nom de dubnium a été donné au 104 pour honorer le laboratoire Flerov à Dubna, où les éléments 102, 104 et 105 ont été trouvés environ au même moment qu’à Berkeley. Les autres noms rendent hommage aux précurseurs anglais, danois, français et allemands dont les travaux de base ont permis ces synthèses artificielles. Grâce à de nouvelles méthodes de production et d’identification, les éléments 110 et 111 ont été créés à la fin de 1994 par l’équipe de Peter Armbruster au laboratoire G.S.I. (Gesellschaft für Schwer-Ionenforschung) de Darmstadt (Allemagne). Leurs durées de vie très courtes (milliseconde) conduisent à penser que la fin du tableau de Mendeleïev est proche de 112 à 114.
1. Découverte des premiers transuraniens
Les éléments transuraniens sont tous produits de façon artificielle par transmutation de noyaux naturels d’uranium et de thorium. La découverte de la radioactivité artificielle avait montré qu’un noyau stable, bombardé par des particules, pouvait se transformer en un autre noyau, généralement radioactif, de masse et de charge différentes. C’est Enrico Fermi qui, après la découverte du neutron, émit l’idée qu’on pouvait systématiquement passer d’un élément à l’élément de Z suivant par réaction nucléaire induite par des neutrons. En effet, l’introduction d’un neutron supplémentaire dans un noyau modifie le rapport neutrons-protons et provoque souvent la radioactivité 廓–. Il s’agit d’une transformation spontanée au cours de laquelle le nombre de nucléons, ou nombre de masse (neutrons + protons = A), reste le même alors que le nombre de protons augmente d’une unité. La constance de la charge est causée par l’émission d’un électron négatif. La transmutation est symbolisée sur la figure 1.
Ce type de réaction nucléaire a été observé sur de nombreux éléments entre 1934 et 1939. Appliqué au cas de l’uranium 23892U, il devait donner un nouvel élément de Z = 93.
Cette recherche du premier des transuraniens, qui aurait dû ressembler au rhénium par sa position dans le tableau périodique, était poursuivie en 1938-1939. Mais, par un des coups de théâtre les plus étonnants de l’histoire des sciences, elle aboutit à l’observation de la fission (cf. chimie NUCLÉAIRE, chap. 4), c’est-à-dire de la rupture en deux fragments du noyau d’un des isotopes de l’uranium 92235U. L’importance de la découverte et de ses conséquences sur la libération d’énergie l’emportait sur l’intérêt de la recherche d’une curiosité qui semblait alors sans incidence pratique. Et, pourtant, seul l’isotope le plus rare de l’uranium, celui de A = 235, était susceptible de fissionner, et la capture des neutrons par l’isotope 238, constituant 99,3 p. 100 de l’uranium, était un phénomène qui inhibait la propagation des fissions en chaîne. Edwin M. McMillan (prix Nobel de chimie avec Glenn T. Seaborg en 1951) démontra, en 1940, que les neutrons captés par l’uranium 238 conduisent à l’uranium 239, lequel décroît par radioactivité 廓– en donnant un nouvel élément lui-même radioactif. Les propriétés chimiques étudiées sur de très faibles quantités indiquèrent qu’il ressemblait plus à l’uranium lui-même qu’au rhénium, et l’énergie de recul mesurée prouvait qu’il ne pouvait être un fragment de fission. Finalement, on a prouvé qu’il s’agissait bien d’un élément de Z = 93, le premier des transuraniens, baptisé neptunium (Np) puisque Neptune gravite au-delà d’Uranus autour du Soleil.
La suite de réactions et de transmutations s’écrit:
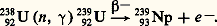
En 1941, les chercheurs de Berkeley montrèrent que le descendant du neptunium 239 (élément 93), lui-même radioactif avec une demi-vie de 2,3 jours, était un nouveau transuranien de Z = 94, le plutonium (Pu):
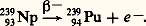
Comme la vie du plutonium était trouvée très longue, il apparaissait évident que d’autres transuraniens pouvaient être produits et observés.
Pour augmenter la valeur de Z, il existe une autre méthode que celle des captures de neutrons suivies de désintégrations 廓–. C’est le bombardement par des particules chargées accélérées par un cyclotron. À Berkeley, Ernest O. Lawrence avait construit un cyclotron susceptible d’accélérer des deutons (noyaux d’hydrogène lourd). En bombardant de l’uranium, Seaborg, Arthur Charles Wahl et Joseph William Kennedy produisirent un autre isotope du neptunium 93238Np, lequel disparaît en quelques jours pour donner l’isotope 94238Pu, dont la radioactivité 見 est facilement mesurable. Ce plutonium, qui constitue de nos jours la source d’énergie des stimulateurs cardiaques, fut le premier isotope découvert de l’élément 94. L’identification chimique fut effectuée au début de 1941, grâce à l’étude des propriétés oxydoréductrices et des conditions d’oxydation par le persulfate.
On peut admirer ces travaux au cours desquels quelques milliers d’atomes d’un élément complètement inconnu étaient produits, séparés et étudiés chimiquement avec la même maîtrise que s’il s’était agi de grammes de matière. Ce travail était d’autant plus délicat que, contrairement aux prévisions, les éléments 93 et 94 ne présentaient pas toutes les similitudes qu’on aurait pu attendre avec les éléments rhénium et osmium, placés en principe au-dessus d’eux dans le tableau périodique. En même temps que l’identification de deux éléments nouveaux, Seaborg, McMillan et leurs collaborateurs découvraient une nouvelle série d’éléments analogues à celle des lanthanides correspondant au remplissage d’une sous-couche électronique intermédiaire [cf. LANTHANE ET LANTHANIDES]. Les éléments au-delà du plutonium furent ensuite synthétisés à Berkeley soit en plaçant du plutonium dans un flux intense de neutrons, soit en le bombardant dans des cyclotrons au moyen de particules chargées diverses, telles les particules 見 (noyaux d’hélium) ou les noyaux de bore, de carbone, d’oxygène, de néon. Jusqu’à l’élément 103, tous appartiennent à la même famille, qui débute à l’actinium (Z = 89) et qui contient donc 14 actinides.
2. Méthodes de production
Captures multiples de neutrons
On peut augmenter la charge d’un noyau par simple addition d’un neutron suivie de désintégration 廓–. On peut faire ainsi la synthèse de l’isotope 239 du neptunium (élément 93). Celui-ci se désintègre lui-même par émission 廓– en donnant l’élément 94, le plutonium 239. Mais cet isotope a un rapport neutrons-protons qui ne favorise plus la désintégration 廓, mais qui provoque au contraire une instabilité par émission de particules 見. Le descendant du plutonium 239 (élément 94) est donc l’uranium 235 (élément 92), et on retombe sur un élément de Z plus faible.
Pour aller vers les Z plus élevés que 94, il faut partir d’une cible de plutonium, mais avec un isotope plus riche en neutrons que celui de A = 239. En plaçant le plutonium 239, séparé de l’uranium et du neptunium, dans le flux de neutrons lents d’un réacteur nucléaire (cf. réacteurs NUCLÉAIRES), les noyaux de cet isotope captent les neutrons et deviennent le plutonium 240, puis le plutonium 241 et le plutonium 242. Trois neutrons sont donc ajoutés aux 145 neutrons, avant que les intermédiaires ne se désintègrent. En effet, le plutonium 240 a une demi-vie de 6 000 ans. C’est ainsi que des quantités importantes du plutonium 242 (demi-vie de 380 000 ans) sont accumulées dans le réacteur à haut flux de Savannah River aux États-Unis. C’est cet isotope qui sert de matériau de base pour la production des transplutoniens, en particulier à Oak Ridge. Le programme T.R.U. (transuranium processing plant ) part de «comprimés» d’oxyde de plutonium 242 et d’aluminium introduits dans une barre du réacteur à 5 憐 1015 neutrons par centimètre carré et par seconde d’Oak Ridge.
Par captures successives de neutrons, on obtient ainsi les isotopes plus lourds 243Pu et surtout 245Pu et 246Pu. La trop grande richesse en neutrons provoque la désintégration 廓– de ces noyaux qui, avec des vies de quelques heures, se transforment en l’élément suivant de Z = 95, appelé américium (Am). Mais ces isotopes d’américium sont eux-mêmes radioactifs et ont pour descendants des noyaux de l’élément suivant (Z = 96), le curium (Cm).
Les isotopes 246Cm, 247Cm, 248Cm ont de très longues vies. Ils sont créés par les captures de neutrons dans le curium 244 et le curium 245 et s’accumulent jusqu’à plusieurs grammes en quelques mois. On peut alors soit procéder à une séparation chimique et isoler le curium, soit laisser le tout plus longtemps. Le jeu des captures de neutrons et des désintégrations 廓– permet d’atteindre les éléments berkélium (Z = 97), californium (Z = 98) jusqu’au nombre de masse 253.
Après plusieurs cycles de production, il est possible d’accumuler, à partir de 10 kilogrammes de plutonium 239, 600 grammes de plutonium 242 et jusqu’à 200 grammes de californium.
Par désintégration 廓– et capture de neutrons, les isotopes 253 et 254 d’einsteinium (Z = 99), et même 254 à 256 de fermium (Z = 100), sont produits à l’échelle du milligramme pour l’einsteinium et du microgramme pour le fermium; la figure 2 résume les réactions nucléaires à partir du plutonium 242, placé pour irradiation dans le réacteur. L’élément le plus important dans cette production est le californium 252, qui peut être fabriqué à l’échelle du gramme. C’est un émetteur 見 de 2,65 ans de période; la chaleur spécifique (fig. 2) dégagée est de 38 watts par gramme. De plus il fissionne spontanément au rythme de 6,2 憐 1011 fissions par seconde et par gramme.
En principe, tout flux très élevé de neutrons arrivant sur une quantité importante d’uranium doit créer des noyaux de transuraniens lointains. Ces flux existent dans certaines étoiles où des éléments transuraniens sont certainement créés. Avec une bombe thermonucléaire, le flux de neutrons est très grand et ne dure que pendant une fraction de microseconde, ce qui favorise les captures, même pour des isotopes d’uranium très riches en neutrons par rapport à la durée de vie 廓–. Jusqu’à 17 neutrons peuvent être absorbés successivement, donnant l’uranium 255, lequel décroît par une cascade d’émissions 廓– jusqu’au fermium 255.
Dans une expérience souterraine baptisée du nom de Hutch par le laboratoire californien de Livermore, une explosion thermonucléaire a produit pendant moins d’une microseconde 1026 neutrons par centimètre carré (flux de 1032 par seconde). Parmi les résidus, on a séparé les éléments einsteinium et fermium jusqu’à A = 257. Ce fermium 257 est l’isotope le plus lourd jamais créé par un flux de neutrons. Sa demi-vie est de 80 jours. On a des raisons théoriques de penser que c’est la limite de ce qu’on peut produire par cette méthode.
Réactions par ions lourds accélérés
Puisqu’il semble impossible d’ajouter plus de 19 neutrons dans un noyau d’uranium, il faut imaginer un autre moyen plus direct d’accroître à la fois la masse A et le nombre atomique Z. Or, depuis quelques années, les accélérateurs de particules sont capables de fournir des faisceaux de projectiles divers, et, par exemple, d’ions carbone, azote, oxygène et même d’ions beaucoup plus lourds comme ceux d’argon ou de krypton (cf. faisceaux d’IONS LOURDS). L’idée très simple est donc de faire pénétrer dans un noyau cible d’uranium (Z = 92, A = 238) un ensemble de Z protons et de A nucléons de façon à atteindre un élément transuranien de nombre atomique (Z + Z ) et de nombre de masse (A + A ). Deux difficultés apparaissent alors:
– Pour qu’un projectile ayant une charge Z s’approche suffisamment d’une cible de charge Z pour fusionner en un nouveau noyau, il faut d’abord vaincre la répulsion électrostatique entre charges de même signe. Cela signifie que les projectiles doivent être portés à une énergie cinétique importante (environ 70 MeV pour des ions carbone et 90 MeV pour des ions oxygène).
– La répulsion vaincue, les deux noyaux (projectile et cible) fusionnent et l’ensemble reçoit beaucoup d’énergie interne. La dissipation de cette énergie provoque non seulement l’émission de quelques neutrons, mais aussi, dans bien des cas, une déformation du noyau telle qu’il se brise en deux fragments plus légers. Cette «fission», qui suit très vite la formation du noyau de fusion, est d’autant plus facile que les transuraniens sont plus lointains. C’est pourquoi, de tous les événements de fusion provoqués par le faisceau d’ions lourds, une faible fraction finit par conduire à des noyaux de transuraniens à l’état fondamental.
Malgré ces deux difficultés, plusieurs isotopes des éléments de Z allant de 101 (mendélévium ) à 111 ont été synthétisés. L’élément 102 (nobélium ) a été obtenu en bombardant du curium 244 par des ions 612C, ou du plutonium 242 par des ions 816O, ou encore de l’uranium 238 par des ions 1020Ne. De même, la découverte de l’élément 103 (lawrencium ), qui porte le nom de l’inventeur du cyclotron, a été faite en bombardant du californium par des ions 510B et 511B. L’élément 104 a été synthétisé sans ambiguïté par le bombardement de curium 248 par de l’oxygène, et, enfin, l’élément 105, par bombardement de californium 249 par de l’azote et de berkélium par de l’oxygène. Les difficultés ont été encore plus grandes pour les éléments 106 à 111, car la section efficace de production est très faible et les demi-vies deviennent très inférieures à la seconde. À Darmstadt, le nouveau mode de réaction utilisé consiste à envoyer des ions beaucoup plus lourds, Cu, Fe, Ni, sur des cibles de plomb ou de bismuth.
3. Propriétés nucléaires
Fission spontanée
Tous les isotopes des éléments de Z supérieurs à 83 sont radioactifs. Cependant, la durée de vie de certains noyaux est très longue, et les deux isotopes 235 et 238 de l’uranium, ainsi que l’isotope 232 du thorium, existent sur la Terre. Il semble qu’on ait trouvé des traces de l’isotope 244 du plutonium dont la demi-vie est 8,2 憐 107 ans. Pour tous les autres transuraniens, les demi-vies sont très inférieures à l’âge de la Terre.
On connaît 16 isotopes du californium, 15 du fermium et une dizaine de chacun des autres transuraniens, sauf au-delà de l’élément 104. Les trois modes principaux de désintégration radioactive rencontrés pour ces éléments lourds sont:
– l’émission 廓– (électrons négatifs) pour les plus riches en neutrons;
– l’émission 見 (noyau d’hélium) pour les plus riches en protons;
– la fission spontanée dont l’importance devient non négligeable pour certains isotopes d’américium (Z = 95), de californium (Z = 98) et au-delà.
L’émission 廓– est un mode de radioactivité qui se produit pour tous les éléments du tableau périodique, dès que le rapport du nombre de neutrons au nombre de protons dépasse une valeur très étroitement définie, correspondant à la stabilité.
Dans la région des transuraniens, cette radioactivité est observée dès que N/Z dépasse 1,57. Par exemple, le neptunium 239 (élément 93), le plutonium 241 (élément 94), l’américium 244 (élément 95), le curium 249 (élément 96), le berkélium 249 (élément 97), le californium 253 (élément 98) sont les plus légers des émetteurs 廓–.
Au-delà de Z = 100, on n’a pas pu jusqu’ici produire d’isotopes assez riches en neutrons pour observer ce mode de désintégration. En revanche, la déficience en neutrons entraîne pour quelques isotopes de 104, 105 et 106 une radioactivité par capture électronique. Un électron du cortège atomique passe dans le noyau et diminue Z d’une unité.
L’émission 見 est un mode de désintégration qui n’apparaît que pour les noyaux déjà lourds, c’est-à-dire pour quelques terres rares et surtout au-delà du bismuth (Z = 83). Elle est due au fait que le noyau d’hélium 24He est une particule très stable, où les deux neutrons et les deux protons sont plus liés que dans les noyaux au-delà du plomb. Il y a donc une tendance naturelle à ce qu’un noyau de Z et de A élevés conduisent respectivement à Z 漣 2 et à A 漣 4, avec émission d’une particule 見. Chaque élément, depuis Z = 93 jusqu’à Z = 105, présente plusieurs isotopes se désintégrant par émission 見 avec des demi-vies qui atteignent 8,2 憐 107 ans pour le plutonium 244 (élément 94), ou, au contraire, quelques secondes pour les plus déficients en neutrons connus comme pour le nobélium 244 (élément 102), ou les Z les plus élevés tel que l’isotope 260 de l’élément 105 (1,65 s). L’énergie des particules 見 est d’autant plus grande que la durée de vie est plus courte. Par exemple, les isotopes des éléments 104, 105, 106 et 107 émettent des particules 見 de 9 à 10,5 MeV, alors que le plutonium 244 a des particules 見 de 4,5 MeV, d’énergie voisine de celle de l’uranium.
La fission spontanée est un mode de désintégration inconnu pour les noyaux plus légers que l’uranium. Au fur et à mesure que le nombre de nucléons A augmente au-delà de la centaine, l’énergie de liaison par nucléon diminue, de sorte qu’un noyau de A = 250 est moins stable que deux fragments de A voisin de 100. La division dégage donc de l’énergie. Mais, jusqu’à l’uranium, elle ne peut avoir lieu spontanément, car, avant de se diviser, le noyau doit être déformé, et l’énergie nécessaire pour provoquer cette déformation doit être fournie. La seule fission observable est donc induite , par exemple par l’entrée d’un neutron dans le noyau d’uranium 235.
Par contre, quand le Z devient très grand, la déformation nécessaire pour la rupture en deux morceaux est de plus en plus faible et peut arriver spontanément au cours de la vie d’un noyau même à l’état fondamental. La probabilité de fission spontanée n’est plus négligeable, et on peut considérer que chaque noyau aura l’occasion d’être rompu en deux fragments à un certain moment de son existence. Il y a donc une vie moyenne par rapport à ce type de disparition du noyau. La plupart des isotopes connus de transuraniens disparaissent par émissions 見 ou 廓–, mais cependant la fission spontanée devient une voie de désintégration importante pour le curium 248 (élément 96), le californium 252 (élément 98), le nobélium 252 (élément 102), et prédominante pour le curium 250, le californium 254, le fermium 256 et 258, le nobélium 258, ainsi que pour les isotopes 258 et 260 de l’élément 104 et l’isotope 261 de l’élément 105.
Au-delà de Z = 105, la théorie prévoit qu’une certaine stabilité par rapport à la fission spontanée réapparaît, si bien qu’en principe des noyaux de Z entre 110 et 114 et de N entre 162 et 170 devraient bien résister à cette désintégration. Mais l’émission 見, très probable, devient la principale cause d’instabilité, et les demi-vies s’abaisseront alors à moins d’une milliseconde, la détection devenant impossible à environ 10 microsecondes.
4. Propriétés chimiques
Structure électronique, transuraniens et actinides
Dès le début de l’étude des propriétés chimiques des éléments transuraniens, le problème de leur place dans la classification périodique s’est posé. Dans le tableau de Mendeleïev (cf. classification PÉRIODIQUE), chaque colonne comprend les éléments ayant la même configuration d’électrons extérieurs, donc des propriétés chimiques analogues. Au contraire, les éléments d’une même ligne possèdent un même nombre de couches électroniques, mais le degré de remplissage de la couche externe croît du début de la ligne (première colonne) à la fin de la ligne (colonne des gaz nobles). Cependant, les couches électroniques sont de plus en plus complexes au fur et à mesure que le nombre atomique croît, et des anomalies de remplissage apparaissent, ce remplissage, pour une même couche, ayant lieu par sous-couche [cf. ATOME]. Pour la première couche, on a seulement deux éléments correspondant à la première ligne. Dans la deuxième couche, deux sous-couches, l’une appelée s , l’autre p , sont remplies successivement, et on obtient la deuxième ligne. La troisième couche comprend trois sous-couches, s , p , d . Pour la quatrième couche, on devrait avoir quatre sous-couches, s , p , d , f . Le remplissage a lieu jusqu’aux électrons d , puis, au lieu de correspondre aux atomes avec électrons f , les éléments suivants sont ceux des couches 5, puis du début de la couche 6. Ce n’est qu’à l’élément lanthane, Z = 57, que le remplissage revient à la couche 4. Alors 14 éléments, appelés «terres rares», ou «lanthanides», forment une série à propriétés chimiques très semblables, car les électrons extérieurs ont la même configuration des couches 5 et 6, et seul le remplissage interne de la couche 4f varie de 1 à 14 [cf. LANTHANE ET LANTHANIDES]. Cette irrégularité doit réapparaître en principe à l’élément 89, l’actinium, pour lequel la couche 5 est remplie à 18 électrons, la couche 6 à 9 électrons (2s , 6p et 1d ) et la couche 7 à 2 électrons. Les niveaux d’énergie des électrons 5f sont aussi bas que ceux des électrons 6d , et le remplissage de la sous-couche interne 5f devrait commencer de la même façon que pour les lanthanides (4f ). Bien que ce phénomène ait lieu de façon plus irrégulière et que les propriétés chimiques observées pour les éléments suivant l’actinium puissent différer fortement, Seaborg a proposé le nom d’actinides pour les 14 éléments débutant au thorium, parmi lesquels le cinquième est le plutonium et le dernier le lawrencium.
Degrés d’oxydation
Les éléments transuraniens ont des propriétés chimiques tout à fait remarquables à cause, en particulier, de la richesse de leurs degrés d’oxydation, ce qui les distingue nettement des lanthanides. Ainsi, le neptunium, le plutonium et l’américium peuvent exister en solution aqueuse aux degrés d’oxydation III, IV, V, VI et même VII en solution alcaline pour le neptunium et le plutonium. La stabilité des états de valence supérieure décroît lorsque le numéro atomique de l’élément augmente, et, à partir de l’américium, le degré d’oxydation III est le plus stable.
En solution moyennement acide et en l’absence d’agents oxydants réducteurs ou complexants, ces éléments existent surtout à l’état de neptunium V, plutonium IV, américium III, curium III (tabl. 2).
À chacun de ces états de valence correspond, en solution aqueuse acide, un type ionique bien défini (M3+, M4+, M2+ et M22+); les liaisons métal-oxygène dans les cations M2+ et M22+ sont très fortes.
À ces formes ioniques correspondent, en solution aqueuse, des colorations variées et caractéristiques (tabl. 3).
À l’état solide, les degrés d’oxydation inférieurs et moyens sont les plus stables, surtout pour les composés binaires tels que les halogénures, les oxydes.
L’aptitude à former des ions complexes et la tendance à l’hydrolyse (interaction avec les molécules d’eau, complexation avec les ions OH–) sont déterminées principalement par la taille et la charge des ions. Par exemple, les ions Pu4+, petits et très chargés, forment des complexes très stables avec différents anions tels que les fluorures et les nitrates; par ailleurs, ils s’hydrolysent facilement et peuvent former, dans certaines conditions, de véritables colloïdes de masse molaire élevée (1010, etc.).
À l’état ionique, les éléments transuraniens forment également des ions complexes avec un grand nombre de substances organiques, ce qui les rend solubles dans ces solvants. Cette propriété est à la base d’importants procédés de séparation, surtout au stade de la fabrication industrielle du plutonium.
Éléments très électropositifs
À l’état métallique, les transuraniens sont très électropositifs. Leur élaboration s’effectue par réduction d’un halogénure à l’aide d’un métal fortement électropositif tel que le calcium ou le baryum. La diversité de leurs formes cristallines est remarquable; ainsi le plutonium métallique présente six variétés allotropiques entre la température ambiante et son point de fusion [cf. PLUTONIUM].
De nombreux composés solides ont pu être préparés: carbures, oxydes, fluorures, halogénures, par exemple, et les transuraniens, qui représentent une extension de plus de 10 p. 100 du nombre des éléments chimiques, ont joué un rôle important dans la renaissance récente de la chimie inorganique. La connaissance des propriétés cristallochimiques des composés d’éléments transuraniens, et plus particulièrement des phases oxygénées, apporte des données nouvelles et fondamentales pour résoudre l’épineux problème posé par la gestion à long terme des déchets nucléaires de haute activité.
Procédés de séparation et de purification
La préparation de certains transuraniens pour des usages militaires ou pacifiques a atteint l’échelle industrielle. Le point de départ est toujours l’irradiation de l’uranium dans un réacteur. Le traitement chimique de l’uranium irradié permet d’isoler, outre le plutonium, divers isotopes (237Np, 241Am, par exemple) pouvant servir de matériaux de départ pour la synthèse d’isotopes d’éléments plus lourds. L’extraction par solvants reste une des techniques les plus classiques pour le traitement des combustibles nucléaires irradiés. Elle est fondée sur la différence de distribution entre deux phases liquides d’ions métalliques ayant formé des composés chélates ou des complexes ioniques. Un des solvants les plus employés est le phosphate de tributyle, mais on lui préfère parfois des amines tertiaires ou des sels d’ammonium quaternaire qui sont moins sensibles aux rayonnements ionisants. Un autre procédé très important de séparation des éléments transuraniens est l’échange d’ions sur résine. Cette technique, d’une grande sélectivité, est rapide et peut être utilisée sur un nombre restreint d’atomes; aussi a-t-elle joué un rôle capital dans la découverte de ces éléments lourds et dans la séparation des transplutoniens.
5. Transuraniens lointains de Z = 99 à Z = 111
La production d’éléments au-delà de l’einsteinium par capture multiple de neutrons devient très difficile sinon impossible même avec des flux colossaux. Or il reste intéressant de créer ces transuraniens lointains pour deux raisons de fond. La première est liée à la stabilité nucléaire. Il est prévu depuis longtemps que le nombre de nucléons et plus particulièrement de protons que peut tolérer un noyau est limité. En effet, les répulsions entre charges ont tendance à le faire éclater spontanément en deux fragments plus stables. La connaissance exacte de la limite au-delà de laquelle cette fission spontanée est immédiate constitue un outil essentiel pour décrire correctement les forces nucléaires agissant pour la cohésion du noyau.
La deuxième est de prolonger le tableau périodique des éléments au-delà du remplissage de la sous-couche 5f , c’est-à-dire des actinides. En principe, cette sous-couche à 14 éléments, analogue à celle des lanthanides, se termine à Z = 103, l’élément suivant devant correspondre au remplissage de la sous-couche 6p , donc devant ressembler aux éléments de la colonne titane, zirconium et hafnium. Produire suffisamment d’atomes 104, 106 et 107 pour étudier leurs caractéristiques chimiques à l’état de traces est donc une gageure intéressante pour les radiochimistes. En 1934, les essais de production du premier élément transuranien par capture de neutrons échouèrent parce que les chercheurs de Rome, Berlin, Paris et Berkeley pensaient que l’élément 93 avait les propriétés du rhénium. En réalité, le remplissage de la couche 5f au niveau de l’actinium, mis en évidence depuis 1940, montre que l’ekarhénium devrait être l’élément 107 récemment découvert, de sorte que le tableau périodique, au lieu d’être comme on le croyait en 1934:
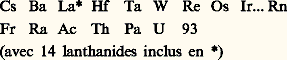
est maintenant:

Comme on l’a indiqué plus haut, la production de ces éléments n’est envisageable qu’en tentant d’additionner un projectile déjà lourd, noyau de carbone, néon ou même argon, titane, chrome à un noyau d’uranium 238 ou éventuellement de 242Pu, 243Am, 248Cm ou même 252Cf, éléments dont on peut disposer en quantité suffisante pour en faire une cible. Par exemple, le mendélévium a été produit, à Dubna en ex-U.R.S.S., à partir d’uranium et de néon:

et le lawrencium a été synthétisé à Berkeley aux États-Unis en 1961, avec 252Cf et des projectiles de bore:

L’histoire des découvertes des éléments 104 et 105 est une série de comptes rendus de résultats controversés échangés entre Dubna et Berkeley. Un accord se fait enfin à l’Union internationale de chimie (I.U.P.A.C.) pour les noms de dubnium et de joliotum. Pour ces deux éléments, les cibles étaient le curium, le californium et l’américium et les projectiles 22Ne, 18O et 15N. Plusieurs isotopes ont été produits qui se désintègrent par fission spontanée et par émission 見. La controverse porte sur les durées de vie, l’importance relative des deux modes de désintégration, le nombre de masse des isotopes et évidemment la priorité de découverte. La compétition Est-Ouest s’exerce en science aussi, et la mauvaise foi n’est pas exclue.
L’élément 106 a été découvert à Berkeley en bombardant 249Cf par 18O. La décroissance 見 en 259104 puis en 102255No lève toute ambiguïté sur l’identification.
Avec l’élément 107, on arrive vraiment aux limites, les durées de vie descendant à quelques millièmes de seconde. La production elle-même se fait avec une très faible section efficace, car la fission immédiate empêche l’agglomération de la cible et du projectile. On a trouvé que le meilleur moyen était de bombarder des cibles un peu plus légères (bismuth) par des projectiles de chrome. Ce sont les Allemands de Darmstadt qui, grâce à leur accélérateur le plus moderne, ont provoqué en 1981 la réaction:

Ce noyau par désintégration se transforme en 258105 puis en 103254Lr et enfin 101250Md. Cette filiation identifie clairement l’isotope père de Z = 107.
À Darmstadt, il a fallu dix ans de perfectionnement des techniques d’identification et de choix des énergies de faisceaux pour passer de 109 à 110. Mais, à la fin de 1994, quelques noyaux de deux isotopes de l’élément 110 ont été isolés après bombardement de plomb par les ions 62Ni et 64Ni. Puis, avec une cible de bismuth (Z = 83), l’élément 111 a été isolé. Enfin, au début de 1995, Dubna a obtenu un autre isotope de l’élément 110 en bombardant 244Pu par des ions de soufre 34. Tous ces noyaux ont des demi-vies de l’ordre de la milliseconde.
Différents isotopes et durées de vie
On a isolé jusqu’ici 14 isotopes de l’einsteinium (243 à 256); la durée de vie la plus longue (275 jours) est celle de l’isotope 254, émetteur 見. Parmi les 18 isotopes du fermium, c’est 257Fm qui a la plus longue durée de vie, 100 jours en émission 見. Des 12 isotopes du mendélévium (Z = 101) c’est 258Mv qui, avec 56 jours, a la plus longue durée de vie. Avec seulement 58 minutes, 259No est le plus lourd et le plus stable des 10 nobélium (Z = 102). Il y a 8 isotopes de lawrencium (Z = 103), le plus stable, 260Lr, n’ayant que 3 minutes de demi-vie; celle-ci descend à 65 secondes pour l’élément 261104 (10 isotopes connus), à 35 secondes pour 262105 (6 isotopes) où la fission spontanée prend le relais de la désintégration 見. Pour Z = 106, 3 isotopes seulement sont connus dont le plus stable, 266, a une demi-vie de 30 secondes. Enfin, pour 261107 et 262107, les durées de vie entrent dans le domaine de la milliseconde.
Propriétés chimiques
Les quantités d’éléments disponibles pour Z 閭 99 sont très faibles, et les propriétés chimiques n’ont pu être étudiées que sur des traces, quelquefois sur quelques dizaines d’atomes.
De Z = 99 à Z = 103, la valence III a été clairement mise en évidence. De façon exceptionnelle on peut réduire Es, Fm, Md en ions 2+, et le nobélium est stable à la valence II.
La valence IV, caractéristique des éléments de transition Ti, Zr, Hf, apparaît pour Z = 104 dont on a préparé le tétrachlorure.
Le chlorure de l’élément 105 est plus volatil que le tétrachlorure d’hafnium et un peu moins que celui de niobium. On peut donc raisonnablement penser que 105 est dans la colonne vanadium, niobium, tantale et forme un pentachlorure.
6. Radioactivité et danger biologique des transuraniens
La radioactivité des transuraniens, utilisée avec succès pour l’analyse ou la détection de très faibles quantités de ces éléments, rend par contre difficile l’étude de leurs propriétés chimiques à l’échelle macroscopique, aussi bien en solution aqueuse qu’à l’état solide. Les rayonnements ionisants émis (particules 見, 廓, rayonnement 塚, fragments de fission, et neutrons pour les nucléides fissiles) décomposent l’eau ou les solvants organiques. L’auto-irradiation des composés solides provoque des altérations du réseau cristallin en créant de nombreux défauts ou des lacunes. Ces dégâts radiatifs entraînent parfois la décomposition rapide des composés. Par exemple, lorsqu’on sépare par filtration un mélange d’oxalates d’américium 241 et de curium 242, à l’échelle du gramme, on observe une décomposition presque instantanée en oxydes qui sont rapidement portés au rouge sous l’effet du rayonnement émis.
Les transuraniens sont des éléments dangereux dont la manipulation requiert des précautions particulières [cf. RADIOPROTECTION]. Les isotopes les plus couramment utilisés présentent à la fois un risque d’«irradiation externe» dû au rayonnement 塚 (c’est le cas de l’américium 241 ou du curium 242) et un risque «biologique» dans le cas d’introduction accidentelle dans l’organisme par inhalation ou contamination cutanée. Leur radioactivité 見, généralement très élevée, jointe à leur ostéotropisme et à leur toxicité chimique, a des effets physiologiques graves. Aussi la concentration maximale, par mètre cube d’air, actuellement considérée comme tolérable est-elle minime, évaluée par exemple à 10–14 gramme pour le curium 242 et à 10–11 gramme pour le plutonium 239 (sous forme d’aérosol, par exemple).
L’accumulation de ces transuraniens à vie très longue dans le parc mondial des réacteurs nucléaires pose un grave problème. On étudie les conditions de stockage avec le maximum de sécurité. Des travaux de recherche sont menés pour les transmuter en fragments légers à vie courte en les soumettant à des flux de protons et de neutrons rapides.
7. Applications
Par tonne d’uranium naturel consommé dans un réacteur à graphite C2, on produit environ 2 kilogrammes de plutonium 239 par an (cf. réacteurs NUCLÉAIRES). On retire chaque année 7 tonnes des deux isotopes 239 et 241 du plutonium des réacteurs E.D.F. à eau pressurisée en fonctionnement en France. La production mondiale dépasse certainement 50 tonnes annuelles, et on connaît mal le stock des armements nucléaires. La mise en œuvre du combustible mox (combustible mixte uranium-plutonium) pour recharger les réacteurs réduira probablement cette surabondance.
Parmi les autres éléments transuraniens, ce sont surtout certains isotopes d’américium, de curium et de californium qui sont utilisés comme sources de rayonnement (cf. RADIOÉLÉMENTS ET RAYONNEMENTS IONISANTS, chap. 7).
Le californium 252, du fait de sa radioactivité par fission spontanée, est un émetteur indirect de neutrons, puisque chaque fission est accompagnée en moyenne de 3,7 neutrons. Il faut se rappeler que 1 gramme de cet isotope conduit à 2,4 憐 1012 neutrons par seconde, alors que l’énergie dissipée est assez faible, donc peu gênante (38 watts par gramme). On peut donc utiliser une source de californium comme générateur de neutrons très maniable, sans aucune contrainte de fourniture de puissance électrique. Cela ouvre à l’activation neutronique un champ de prospection considérable puisqu’il n’est plus nécessaire de transporter des échantillons vers un réacteur nucléaire. Entre autres, l’exploration des gisements sous-marins peut se faire avec de grands avantages, l’eau servant de ralentisseur de neutrons, et les neutrons thermalisés provoquant soit de la diffusion sur les atomes légers (recherche du pétrole), soit des réactions nucléaires (n , 塚). Par exemple, avec 200 microgrammes de californium, on peut rechercher le manganèse par la réaction 55Mn (n , 塚) 56Mn, l’isotope 56 du manganèse, radioactif, pouvant être détecté par son rayonnement 塚 de 2,12 MeV (demi-vie de 2,58 heures). Un bateau peut transporter à la fois la source de neutrons et le détecteur 塚 et l’immerger pour l’exploration des sols sous-marins.
L’américium 241 est utilisé en raison du rayonnement 塚 de 60 keV qu’il émet. Cette énergie est voisine de celle des rayons X, et, comme la demi-vie de l’américium 241 est longue (458 ans), on peut remplacer un tube à rayons X par une source d’américium. Cela peut être très utile pour l’analyse par fluorescence X, technique très employée et dont la maniabilité est très accrue par l’existence d’une source portable.
Mais ce sont surtout comme sources peu encombrantes de puissance que les isotopes 238Pu, 244Cm et 242Cm sont utilisés. Une pastille de 1 gramme d’oxyde 244Cm2O3 dégage 2,45 watts, et la demi-vie de cet isotope est de 18 ans. Avec l’isotope 242 de 163 jours, on obtient 43 watts par gramme du mélange 242Cm23-242Am2. Comme l’américium a une demi-vie de 152 ans et se transforme en curium, on peut avoir une source de longue vie de puissance spécifique élevée.
Le plutonium 238 ne dégage que 0,40 watt par gramme d’oxyde de plutonium Pu2. On a réalisé de nombreux générateurs thermoélectriques utilisant du plutonium 238 comme source d’énergie. Par exemple, S.N.A.P. 27, pour les missions Apollo, supportait des variations de température de 漣 100 0C à + 100 0C et produisait 1 480 watts.
L’intérêt particulier du plutonium 238, de 86,4 ans de demi-vie, est qu’il n’émet que des particules 見, sans fission spontanée ni rayonnement 塚 pénétrant. Si l’on utilise l’oxyde Pu2 avec de l’oxygène enrichi en isotope 18, la réaction ( 見, n ) sur l’oxygène a une section efficace faible (cf. chimie NUCLÉAIRE, chap. 3), et le flux des neutrons indirectement produits est faible. Ainsi, le plutonium 238 devient une source d’énergie sans émission de rayonnement important en dehors de l’enveloppe du générateur, puisque les particules 見 sont aisément arrêtées par une paroi mince.
Cela a conduit à l’utilisation de plutonium 238 comme source d’énergie sans danger pour les stimulateurs cardiaques. Il est obtenu comme descendant du neptunium 238, lui-même issu de la réaction (n , 塚) sur le neptunium 237 (élément 93). Ce dernier isotope, de durée de vie de 1 million d’années, est synthétisé à partir de l’uranium 238 par la réaction:

Ainsi, alors que l’isotope 239 du plutonium a jusqu’ici surtout servi à des œuvres de destruction (bombe thermonucléaire), son voisin, le plutonium 238, est entièrement utilisé à sauver des vies humaines. Enfin, 252Cf est également susceptible d’applications médicales par l’irradiation aux neutrons de certaines tumeurs pour lesquelles le traitement aux rayons 塚 reste inefficace.
Encyclopédie Universelle. 2012.