MÉTABOLISME
Rien ne se crée, rien ne se perd. Le principe de conservation de l’énergie et de la matière ne souffre aucune exception. Aussi les êtres vivants ne sont-ils que des transformateurs d’énergie: ils reçoivent du dehors de l’énergie chimique et ils la transforment en une autre forme d’énergie chimique ou en énergie électrique ou mécanique.
Au flux d’énergie à travers l’organisme correspond un flux de matière. C’est ce flux de matière qu’on désigne du nom de métabolisme, qui signifie étymologiquement «transformation». On parle de métabolisme de matière et de métabolisme énergétique. Le premier permet la connaissance précise de la nature de ces transformations et des mécanismes et fonctions qui les rendent possibles. Le second se contente du bilan général des transformations, car le seul facteur qui joue au point de vue énergétique est la différence entre l’état initial et l’état final. Il est indifférent, au point de vue énergétique, que la combinaison du carbone avec l’oxygène se fasse en deux temps, avec la formation intermédiaire d’oxyde de carbone, ou, en un seul temps, avec production d’emblée d’anhydride carbonique.
1. Le métabolisme énergétique
C’est seulement cent ans environ après Lavoisier que Berthelot a montré que l’énergie dégagée par la combustion des aliments dans l’organisme se calculait par la différence entre la chaleur de combustion des aliments et celle des déchets éliminés. En d’autres termes, ce qui importe est la différence entre l’état initial et l’état final.
Berthelot a construit une «bombe calorimétrique» pour mesurer la chaleur dégagée par un aliment qui brûle. Pour effectuer cette combustion, il lui a fallu mettre l’aliment en présence d’une pression de 25 atmosphères d’oxygène pur.
Lors de la combustion de représentants des trois classes d’aliments énergétiques (lipides, glucides, protides), Berthelot a calculé que 1 g de graisse dégage 9,1 kcal (kilocalories, ou grandes calories [Cal]), 1 g de sucre 4,1 kcal et 1 g de protide 5,6 kcal. Mais, si le produit terminal de la combustion des lipides et des glucides est le même dans la bombe et dans un organisme vivant (la combustion, complète dans les deux cas, aboutit à C2 et H2O), il n’en est pas de même pour les protides.
Dans la bombe, les protides sont transformés en nitrates, alors que les Mammifères, en particulier, éliminent le produit terminal du métabolisme azoté sous forme d’urée, CO(NH2)2. Or ce corps brûle encore dans la bombe et dégage 2,5 kcal par gramme. La chaleur de combustion des protides dans l’organisme n’est donc que de 4,1 kcal par gramme.
Les particularités de la machine animale ne se limitent pas à ce seul problème; dans l’organisme vivant, l’énergie chimique est en effet utilisée directement et non pas, comme dans une machine thermique, par l’intermédiaire de la chaleur. Dans ce dernier cas, il faudrait une différence de plus de 100 0C entre le point chaud et le point froid.
De plus, si, comme l’a vu Berthelot, l’énergie que tire l’organisme vivant des aliments ne dépend que de la différence entre l’état initial et l’état final, comme dans l’équation suivante:

– on peut établir des formules analogues pour les lipides et les protides –, la voie métabolique réalisée dans l’organisme est progressive et complexe.
Les aliments transformés par la digestion en «nutriments» ne sont pas des corps aisément combustibles. Pour les brûler, Berthelot a été obligé de réaliser dans sa bombe calorimétrique une pression partielle d’oxygène très élevée.
Dans l’organisme, où ne règne qu’une pression partielle d’un septième d’atmosphère (108 mm Hg), la présence de multiples catalyseurs (enzymes) permet d’amorcer les transformations qui aboutissent à la libération d’énergie. Les mécanismes de cette libération d’énergie, représentés par une série d’oxydations et de réductions, sont exposés dans la deuxième partie de cet article (cf. chap. 2).
Les méthodes de mesure de la dépense d’énergie
On dispose de deux voies différentes pour mesurer la dépense d’énergie d’un être vivant: la calorimétrie directe et la calorimétrie indirecte.
La calorimétrie directe
La calorimétrie directe exige un appareillage coûteux et, en général, malaisé à manipuler. Pendant de nombreuses années, on a fait appel à la calorimétrie différentielle. À la chaleur à mesurer dégagée par un être vivant placé dans une enceinte calorimétrique, on oppose dans ces montages celle que produit une source artificielle, réglable à volonté (fig. 1). La quantité de chaleur dégagée par la résistance électrique (Q = Ai2Rt, où Q = kcal ou en joules, i = intensité du courant en ampères, R = résistance en ohms, t = durée en secondes, A = 1/J = 0,000239) est égale à la chaleur dégagée par l’animal. Pour recueillir la chaleur, on utilise des thermocouples ou des bolomètres, c’est-à-dire des résistances électriques variant en fonction de la température. L’égalité des deux sources de chaleur est indiquée par un galvanomètre monté sur un pont de Wheatstone, dans lequel on compare les résistances des deux bolomètres.
Actuellement, on recueille séparément la chaleur latente de vaporisation – l’homme émet toujours de l’eau par ses voies respiratoires et par sa surface cutanée, même quand il ne transpire pas –, la chaleur rayonnée, la chaleur perdue par convection. Le calorimètre de Benzinger et Kitzinger permet de mesurer avec précision toutes ces formes de chaleur chez l’homme. Il s’agit d’un appareil extrêmement coûteux.
À la fin du XIXe siècle, C. Liebermeister a imaginé une méthode très simple et peu coûteuse: l’homme dont on désire connaître la production de chaleur est plongé dans une baignoire; on suit d’abord l’évolution de la température de l’eau seule, puis on effectue la même mesure en présence du sujet, source de chaleur. Une chambre calorimétrique fut ensuite construite par J. Lefèvre sur le même principe.
La calorimétrie indirecte
La calorimétrie indirecte repose soit sur la thermochimie alimentaire, soit sur la thermochimie respiratoire.
Dans la thermochimie alimentaire , appelée méthode des bilans, on fixe la chaleur de combustion des aliments ingérés et on en défalque la chaleur de combustion des déchets, en tenant compte des variations des réserves. En effet, s’il y a eu par exemple mise en réserve de 20 g de graisses, la chaleur de combustion de ces 20 g devra être déduite du nombre total de calories fournies par la ration. Pour se rendre compte de l’état nutritionnel d’un pays, les enquêtes de l’O.M.S. (Organisation mondiale de la santé) sont fondées simplement sur la valeur énergétique de l’ensemble des aliments distribués durant une période donnée à une population exactement dénombrée.
La thermochimie respiratoire tient compte de la quantité d’oxygène utilisée pour «brûler» les aliments. Comme l’organisme tire son énergie de l’oxydation des substances alimentaires, il est évident que, si la quantité de substances «brûlées» augmente, la quantité d’énergie libérée Q augmente d’une façon rigoureusement proportionnelle, et donc aussi la quantité d’oxygène utilisée:
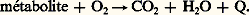
Pour chaque substance, il y a donc une proportionnalité directe entre l’énergie libérée et la quantité d’oxygène VO2 consommée:

Ainsi, connaissant la quantité d’oxygène consommée, on peut calculer l’énergie libérée si l’on connaît le coefficient de proportionnalité C. Ce coefficient est le coefficient thermique de l’oxygène pour une substance alimentaire donnée. Il est bon de mesurer parallèlement les quantités de dioxyde de carbone et d’eau produites. Le nombre des techniques dont on dispose à l’heure actuelle est considérable. Il y en a de très simples, précises et rapides. On peut mesurer aussi bien la consommation d’oxygène des mitochondries d’une cellule que celle d’un gros mammifère.
Dès 1894, M. Rubner a obtenu chez le chien la même valeur en mesurant la chaleur recueillie dans un calorimètre ou en la calculant à l’aide des données de la thermochimie alimentaire. En 1902, W. O. Atwater et F. G. Benedict ont trouvé chez l’homme un accord parfait entre les résultats acquis par calorimétrie directe, par thermochimie alimentaire et par thermochimie respiratoire.
L’identité des résultats obtenus par deux voies d’investigation indépendantes a été la preuve expérimentale de la validité du principe de conservation d’énergie chez les êtres vivants.
Les sources contingentes de la dépense d’énergie
Le métabolisme d’entretien actif
En dehors de la dépense d’énergie liée à la vie et à la respiration des cellules, on sait depuis Lavoisier qu’il existe trois causes susceptibles d’augmenter cette dépense dite basale: le travail musculaire, l’augmentation de la production de chaleur pour résister au refroidissement, l’augmentation de la production de chaleur due à la prise d’aliments.
Le travail musculaire
Parmi ces trois sources de dépense d’énergie supplémentaire, celle qui est due au travail musculaire est de beaucoup la plus importante: dans un effort extrême, de courte durée, l’organisme humain réussit à multiplier sa dépense par dix et quinze, l’athlète par vingt. Il est toutefois exceptionnel de rencontrer des dépenses d’énergie au cours d’un nycthémère qui dépassent de cinq fois la dépense de repos. Pratiquement, de telles dépenses ne surviennent que durant les périodes d’entraînements des équipes sportives.
Un homme de 60 à 70 kg, couché huit heures sur vingt-quatre, se déplaçant à pied durant deux heures, debout durant deux heures et assis durant douze heures, dépense environ 2 500 kcal par jour, soit un peu plus de 100 kcal par heure. On fixe la «dépense de base» de ce même individu à environ 50 kcal/h. Quand ce dernier effectue une marche au rythme de 5,6 km/h, sa dépense est de 173 kcal (tabl. 1). À ce rythme, les muscles des extrémités augmentent leur dépense de treize fois; sous cet effet, une masse de sang importante est détournée des organes profonds vers les muscles; l’apport en oxygène vers les glandes (le rein en particulier) est réduit de 40 p.100.
Le rendement maximal du moteur humain est d’environ 30 p. 100, c’est-à-dire que, pour une calorie effectivement transformée en travail, un peu plus de trois sont dépensées par l’organisme. Dans les conditions ordinaires, ces calories supplémentaires servent à maintenir la température constante et couvrent une partie de la thermogenèse de réchauffement.
La thermogenèse de réchauffement
Les recherches de J. Giaja (1938) ont montré que la dépense d’énergie maximale que peut réaliser un mammifère ou un oiseau dans la lutte contre le froid est de l’ordre de trois à quatre fois la valeur de la dépense basale. Mais Giaja lui-même a déjà relevé que cette valeur dépend fortement de la durée de l’exposition au froid. Il a été constaté récemment que, quand on expose durant vingt-quatre heures à 12 0C un rat blanc qui vit normalement à 30 0C, sa température centrale commence à baisser tandis que ses échanges respiratoires ne sont que doublés.
Pratiquement, l’augmentation de la dépense d’énergie provoquée par le froid ne se manifeste, chez l’homme, que lors des bains froids. En effet, l’Eskimo et l’habitant des climats tempérés se protègent par leurs vêtements contre les basses températures et ne séjournent au froid que le temps indispensable au travail à effectuer en dehors de l’habitat: la ration du soldat américain cantonné en Alaska ne diffère pas quantitativement de celle du soldat effectuant son service dans le Middle West.
L’énergie thermique maximale que l’organisme développe dans sa lutte contre le froid constitue ce que Giaja a appelé le «métabolisme de sommet».
La prise d’aliments
L’alimentation entraîne une augmentation à long terme et une augmentation à court terme de la dépense d’énergie.
Les expériences de jeûne partiel, effectuées au laboratoire de A. Keys (1950) sur des volontaires qui ne recevaient durant vingt-quatre semaines qu’une ration de 1 570 kcal par vingt-quatre heures au lieu de 2 500, ont montré qu’à la fin de l’expérience les sujets avaient réduit leur dépense de 39 p. 100. En même temps, la perte de poids corporel a été de 20 p. 100. Il en résulte que la diminution de la dépense d’énergie, rapportée à un kilo, est de 19,5 p. 100. Il y a donc parallélisme entre la réduction de la masse corporelle et la diminution de la dépense d’énergie par unité de poids.
En dehors de cette dépense qui correspond à une adaptation chronique au niveau énergétique des entrées alimentaires, on connaît depuis Lavoisier et Rubner une hausse de la dépense d’énergie liée à l’alimentation: un chien qui reçoit une ration dépassant de 50 p. 100 celle de ses besoins, c’est-à-dire celle qui assurerait la constante de son poids, présente après ingestion des aliments une augmentation de ses échanges respiratoires de 20 p. 100 s’il a fait un repas riche en protéines, de 10 p. 100 si l’apport calorique était essentiellement constitué par des farineux, de 6 p. 100 s’il était composé surtout de graisses. Cette augmentation, particulièrement nette chez le chien ingérant de la viande, se manifeste encore quand on injecte des acides aminés dans les veines. Il ne s’agit donc pas d’une dépense liée à la digestion intestinale. Rubner a utilisé le terme d’« action dynamique spécifique» pour désigner cet effet des protides. Pour le lapin, chez lequel l’action dynamique des glucides est très accusée, la production supplémentaire de chaleur correspond exactement au coût de la transformation des glucides en lipides. Il est donc probable que l’action dynamique spécifique traduit le coût énergétique de la transformation des glucides et des protides en graisses de réserve (T. Cahn et J. Houget, 1962).
Le métabolisme de croissance
La croissance d’un organisme entraîne une dépense supplémentaire d’énergie; on ne peut augmenter, sans frais, sa masse corporelle. Le rendement de la croissance pour le développement de l’œuf (F. Tangl, 1903) et la croissance du nourrisson (Rubner) est très bon, de l’ordre de 60 à 70 p. 100.
Le métabolisme de base
Quand on a éliminé toutes ces sources de production de chaleur supplémentaire, il reste une dépense minimale, dite métabolisme de base ou dépense de fond, liée à la respiration même des cellules qui constituent l’organisme vivant.
Chez l’homme adulte, cette dépense est de l’ordre de 1 600 kcal/24 h. C’est la valeur que l’on obtient chez l’homme couché, au repos complet, dix-huit heures après un dernier repas très léger, en l’absence de toute stimulation thermogène. On supprime ainsi le travail extérieur, le travail de la digestion, et l’on évite la dépense d’énergie due à la réaction contre la température ambiante. J. A. Harris et F. G. Benedict (1919) ont mesuré avec précision cette «énergie physiologique minimale» chez un certain nombre d’individus dont ils connaissaient le poids, l’âge, la taille et le sexe. Ils ont réussi à établir une formule linéaire de «prévision» qui permet, à l’aide des données énumérées, de connaître à moins de 5 p. 100 près le métabolisme de base. Pour l’homme, cette formule s’écrit:
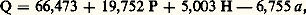
,
où Q = quantité de chaleur en kilocalories par vingt-quatre heures, P = poids en kilos, H = hauteur en centimètres et a = âge en années.
Les mêmes auteurs ont développé une formule analogue pour la femme. Ces formules sont dépourvues de toute signification biologique puisque, en s’y référant, on trouverait encore un «métabolisme de base» pour un homme ou une femme de poids zéro.
La recherche d’une unité de référence significative a depuis longtemps préoccupé les hygiénistes. En 1838, F. Sarrus et J. Rameaux de Strasbourg ont cru pouvoir affirmer que la dépense d’énergie était proportionnelle à la surface corporelle; C. Bergmann (1847), M. Rubner (1883) et C. Richet (1889) ainsi que H. von Hoesslin (1888) ont contribué de façon très importante à résoudre le problème de la «loi des surfaces».
Or, l’accord entre les productions de chaleur par mètre carré de surface corporelle et par vingt-quatre heures n’est bon ni chez les poïkilothermes, ni chez les homéothermes. Ainsi, la souris blanche produit 550 kcal/m2/24 h et l’éléphant 2 060. Aussi Benedict et Harris ont-ils toujours refusé d’admettre la validité de cette loi.
Cela signifie-t-il que la loi des surfaces est une conception entièrement fausse? Si l’on tient compte de la perte de chaleur sous forme latente et de la surface rayonnante réelle, qui peut être déterminée par divers procédés (la photographie sous différents angles par exemple), on constate une constance de l’émission de chaleur par unité de surface dans l’espèce humaine. Mais cette constatation n’est, en réalité, que le contrôle de l’homéothermie: les évaluations correctes de la déperdition prouvent que la production est identique à la déperdition.
Les premières tentatives pour relier poids et surface sont dues à K. Meeh (1879), qui a établi la formule:

en évaluant la surface géométrique par le procédé des bandelettes de papier. Considérant qu’on peut prendre comme densité du corps celle de l’eau, il aboutit à représenter la surface comme P23 ou P0,67, les surfaces croissant comme le carré des dimensions linéaires (S = kl 2) et les masses comme les cubes (P = kl 3). La valeur k varie avec la forme géométrique. De fait, M. Kleiber (1931-1932) et S. Brody (1932), tous les deux vétérinaires et nutritionnistes, ont montré que l’exposant qui relie le métabolisme de base au poids n’était pas de 0,67 mais de 0,73 (Brody) ou 0,75 (Kleiber). Quand on note sur un graphique la dépense d’énergie de la souris de 20 g jusqu’à celle de l’éléphant de 4 t en inscrivant toutes les espèces de poids intermédiaires, l’homme y compris, on trouve (Brody) une relation du type:

La même recherche effectuée sur des Reptiles et des Batraciens (Kayser) donne une formule similaire:

L’identité de l’exposant du poids dans les deux équations prouve que ce ne peut pas être la surface qui dicte la production de chaleur. Si l’on retrouve la même formule chez les poïkilothermes et les homéothermes – avec la seule différence que chez ces derniers le facteur constant est environ 35 fois plus fort –, cela est dû au fait que la chaleur produite s’écoule chez les deux de la même manière par la surface libre.
La signification réelle de la loi des surfaces se dégage des recherches de H. von Hoesslin (1888) et de R. Lambert et G. Teissier (1927). En comparant la production de chaleur d’espèces différentes, allant de 70 kg (homme) à 250 g (rat), H. Von Hoesslin a vu qu’effectivement la production de chaleur par unité de surface était constante. Mais il a refusé d’en conclure que la surface déperditrice commandait la production: en effet, en plaçant deux chiens de même poids à deux températures différentes, 5 0C et 31 0C, il constate que le chien vivant à 5 0C augmente ses échanges de 12 p. 100 par rapport au chien vivant à 31 0C; mais la perte de chaleur du chien vivant à 5 0C est de quatre à cinq fois plus forte que celle de l’autre animal. Il faut donc trouver une autre explication de la loi des surfaces.
Von Hoesslin arrive à la conclusion que la loi des surfaces est l’expression d’une organisation anatomique en rapport avec le transport de l’oxygène: la vitesse du sang dans les artères d’un chien de 5 kg étant à peu près la même que dans celles d’un cheval de 300 kg, le débit circulatoire (rapport d’oxygène aux différents tissus) dépend du diamètre des vaisseaux. Comme le rapport des surfaces de section de deux vaisseaux homologues est le même que celui des surfaces de section des corps entiers, il en résulte que le transport de l’oxygène est lié à la surface corporelle.
Lambert et Teissier ont complété la conception de «similitude anatomique» de Von Hoesslin en introduisant les «durées» dans les comparaisons biométriques. Pour ces auteurs, l’intervalle entre deux systoles cardiaques est tout aussi caractéristique d’une espèce qu’une longueur corporelle. Ils font un pas de plus et admettent qu’ils ont le droit de considérer le rapport entre deux longueurs homologues chez deux individus comme identique au rapport de deux temps homologues. Ils arrivent par conséquent à écrire:

À partir de leur hypothèse, ils définissent l’équation de dimensions d’une puissance et d’un débit:

La production de chaleur est une puissance; elle est donc proportionnelle à la surface. On peut ainsi considérer la loi des surfaces comme une loi d’évolution pour des corps géométriquement semblables, construits sur le même type. De fait, E. F. Adolph (1949) a montré que toute une série de débits (débit de l’azote ou de l’urée urinaires, du soufre, etc.) – qui eux aussi, comme les puissances, sont proportionnels à la surface –, se faisait selon l’expression: Q = k Pb , où b a des valeurs allant de 0,72 à 0,77.
La conception de Teissier permet de comprendre les observations faites par E. Zeuthen, qui en 1947 a rassemblé les valeurs des consommations d’oxygène de la micro-faune marine, des Invertébrés en général, des Vertébrés poïkilothermes et homéothermes, et a retrouvé partout cette même relation, où seule diffère la valeur de k : ce coefficient augmente d’une unité logarithmique quand on passe des Invertébrés poïkilothermes aux Vertébrés poïkilothermes, et d’une nouvelle unité des Vertébrés poïkilothermes aux Mammifères et Oiseaux homéothermes. Dans l’ensemble des valeurs obtenues sur les Mammifères et les Oiseaux ou les Reptiles et Batraciens, on voit qu’il n’y a pas de différence significative entre les valeurs de 0,67 et 0,73 de l’exposant du poids.
En conclusion, l’expression la meilleure du métabolisme de repos correspond à la formule de Brody (Q24 = k 憐 P0,73); cette formule peut gagner en précision à l’aide de valeurs différentes données à k selon qu’il s’agit de Poissons, de Batraciens, de Reptiles, de Mammifères ou d’Oiseaux. On peut même l’adapter à un ordre déterminé comme celui des Rongeurs. Elle est alors assez précise pour permettre l’établissement d’une ration alimentaire de repos, la ration étant considérée uniquement comme apport énergétique.
Mais cette formule a aussi un fondement théorique rationnel; elle traduit une réalité biologique: la dépense d’énergie d’un être vivant a la dimension physique d’une puissance.
2. Le métabolisme intermédiaire
Le métabolisme intermédiaire a été souvent défini comme l’ensemble des phénomènes de dégradation (catabolisme) et de synthèse (anabolisme) qui permettent un cycle continu d’échanges entre la cellule et les substrats apportés par l’alimentation: glucides, lipides et protides. Actuellement, ce terme désigne deux types de processus biochimiques: l’un, variable, avec les divers substrats; l’autre, appelé «système métabolique central», identique pour toutes les cellules animales et végétales: alimenté en petites molécules par le premier, il fournit à l’organisme l’énergie qui lui est nécessaire, mais aussi des matériaux pour des biosynthèses. Le système métabolique central, situé dans les mitochondries des cellules animales et végétales, comprend deux ensembles multienzymatiques associés aux structures mitochondriales: le cycle citrique et les chaînes d’oxydoréduction.
Le cycle citrique (ou cycle tricarboxylique, ou cycle de Krebs) a pour rôle essentiel, mais non exclusif, l’oxydation en gaz carbonique et en eau d’une unité à deux atomes de carbone, l’acétyl-coenzyme A, dénominateur commun du catabolisme glucidique et lipidique. Au cours du cycle, les oxydations des substrats libèrent de l’hydrogène; celui-ci, transporté sur les chaînes d’oxydoréduction, permet la production d’énergie, rôle majeur de ce cycle biochimique. De plus, le cycle de Krebs fournit des matériaux pour des biosynthèses. Ce système, qui oriente les molécules vers le catabolisme ou l’anabolisme, est régulé par des mécanismes de contrôle dont on commence à entrevoir la complexité.
Les chaînes d’oxydoréduction , dont l’étude est entreprise dans l’article OXYDORÉDUCTIONS BIOLOGIQUES, reçoivent les protons (H+) arrachés aux substrats pendant le déroulement du cycle citrique et libèrent de l’énergie sous forme d’acide adénosine triphosphorique (ATP), accumulateur et générateur d’énergie à la demande.
Le cycle citrique et les chaînes d’oxydo-réduction phosphorylante, ainsi couplés, représentent pour toutes les cellules le mécanisme biochimique capable de fournir de l’énergie utilisable.
Le système métabolique central
Le cycle citrique
Le cycle citrique est la pierre angulaire du système métabolique central. Les réactions biochimiques de ce cycle sont représentées dans la figure 2.
La condensation de l’acétyl-coenzyme A avec l’oxaloacétate conduit à la formation du citrate, acide tricarboxylique à six atomes de carbone, qui a donné son nom au cycle. L’enzyme, découverte par S. Ochoa et ses collaborateurs, appelée enzyme condensante ou citrate-synthétase, catalyse une réaction complexe dont l’équilibre est fortement déplacé en faveur du citrate. La citrate-synthétase a, en effet, trois fonctions: énolasique, lyasique et hydrolasique (fig. 3; cf. ENZYMES). L’enzyme de condensation est inhibée par les acyl-CoA à longue chaîne, et notamment par le palmityl-CoA, selon un mode allostérique.
La conversion du citrate en isocitrate est catalysée par l’aconitase (aconitate-hydratase), qui exige la présence de Fe2+. Cette étape, dont on suppose qu’elle procède par l’intermédiaire d’un cation carbonium, est caractérisée par la formation d’un équilibre entre le citrate, le cis-aconitate et l’isocitrate (respectivement 89, 3 et 8 p. 100; fig. 4). Le citrate, composé de structure moléculaire symétrique, a un comportement asymétrique en présence de l’aconitase. A. G. Ogston pense que cette dernière propriété est liée au fait que le citrate s’attache en trois points situés à la surface de l’enzyme; l’adhérence qui en résulte favorise l’approche d’un ion OH- d’un seul côté et la genèse d’un composé asymétrique, possédant deux carbones asymétriques: l’isocitrate. De plus, grâce à des substrats marqués, on a montré que seule la partie du citrate provenant de l’oxalo-acétate est déshydratée, et non celle issue de l’acétyl-CoA, ce qui est une preuve supplémentaire du comportement asymétrique du citrate en présence de l’aconitase: en effet, après action de la citrate-synthétase, de l’aconitase et de l’isocitrico-déshydrogénase, on n’obtient qu’un seul type d’ 見-cétoglutarate radioactif marqué en 見 du carboxyle (fig. 5, réaction a). L’ 見-cétoglutarate marqué en 塚 n’est pas formé (fig. 5, réaction b).
Le passage de l’isocitrate à l’ 見-cétoglutarate est réalisé par l’isocitrico-déshydrogénase, qui catalyse simultanément l’oxydation de l’acide isocitrique en acide oxalosuccinique et la décarboxylation de ce dernier en acide 見-cétoglutarique. Deux enzymes différentes sont connues: l’une, nicotinamide adénine dinucléotide phosphate (NADP+) dépendante, intra- et extramitochondriale, source de NADPH2 pour des synthèses; l’autre, nicotinamide adénine dinucléotide (NAD+) dépendante, exclusivement intramitochondriale, dont l’action est irréversible. Activée par l’ADP, inhibée par l’ATP, cette enzyme joue un rôle important dans la régulation du cycle citrique par un mécanisme allostérique.
L’oxydation de l’ 見-cétoglutarate en succinyl-coenzyme A est effectuée par l’ 見-cétoglutarate-oxydase. La réaction globale (1), irréversible, est catalysée par un système multi-enzymatique que l’on peut scinder en trois enzymes (fig. 6):
– une 見-cétoglutarate-décarboxylase, qui contient du pyrophosphate de thiamine (TPP) comme groupement prosthétique; elle est responsable de la décarboxylation et conduit à un complexe semi-aldéhyde succinique lié à la thiamine;
– une lipoyl-réductase trans-succinylase, qui catalyse le transfert du résidu succinyl sur l’acide lipoïque avec ouverture du pont disulfure, puis le transfert de ce résidu sur la coenzyme A;
– une dihydrolipoyl-déshydrogénase, comprenant une flavoprotéine, qui régénère le pont disulfure de l’acide lipoïque en transférant l’hydrogène au NAD+. La décarboxylation de l’ 見-cétoglutarate est oxydative.
Passage du succinyl-coenzyme A au succinate : la liaison riche en énergie du succinyl-CoA peut être, soit conservée grâce à l’intervention de la succinyl-CoA-synthétase qui catalyse la réaction (2) (le guanosine triphosphate [GTP] peut lui-même transférer son phosphate terminal à l’ADP pour donner de l’ATP et régénérer le GDP initial), soit transférée en même temps que la coenzyme A à l’acétoacétate, dans le muscle cardiaque, ou squelettique, par la succinyl-acétylacétate-thiophorase [réaction (3)].
L’oxydation du succinate en fumarate introduit une double liaison dans le fumarate. La succino-déshydrogénase est une flavoprotéine, flavine adénine dinucléotide (FAD) dépendante, comportant quatre atomes de fer non héminique par molécule. Cette enzyme est inhibée par le malonate; c’est un exemple classique d’inhibition compétitive [cf. ENZYMES].
L’hydratation du fumarate en L-malate , catalysée par la fumarase (fumarate-hydratase), conduit au L-malate. À l’équilibre, 82 p. 100 de L-malate sont formés.
L’oxydation du L-malate en oxaloacétate est réalisée par la malico-déshydrogénase, enzyme NAD+ dépendante, activée par des concentrations élevées de L-malate et inhibée par l’oxaloacétate. Ainsi se termine le cycle, régénérant son «starter», l’oxaloacétate.
Bilan du cycle et chaînes d’oxydoréduction
Le bilan d’un «tour» de cycle est le suivant (fig. 2):
1. Élimination de deux atomes de carbone sous forme de deux CO 2, lors des décarboxylations de l’isocitrate et de l’ 見-cétoglutarate. Toutefois, il faut remarquer que, du fait de l’action dissymétrique de l’aconitase sur le citrate, les deux atomes de carbone éliminés au cours des étapes décarboxylantes ne proviennent pas de l’acétyl-CoA, mais de l’oxaloacétate, dans lequel on retrouve, en fin de cycle, les carbones du radical acétyle. Cette notion fut apportée par les études faites avec des radioéléments différents fixés sur les deux groupements carboxyliques de l’oxaloacétate (fig. 2).
2. Transfert de quatre paires de protons (H+) et d’électrons aux chaînes d’oxydoréduction. Le fonctionnement des chaînes d’oxydoréduction peut être résumé par les deux équations (4). La réaction d’oxydation (a) est normalement couplée à la réaction de phosphorylation (b); celle-ci est possible grâce à l’énergie produite au cours des oxydations; le résultat global est la formation d’ATP.
Le transfert des protons et des électrons a pour conséquence, en plus de la formation d’eau, celle de onze liaisons riches en énergie; le rapport P/O entre le nombre de liaisons phosphates riches en énergie et le nombre d’atomes d’oxygène absorbés pour un type de cellule (ou quotient de phosphorylation) est de trois lors de l’oxydation de l’isocitrate, de l’ 見-cétoglutarate et du malate, et de deux seulement pour celle du succinate. L’étape (5) de la figure 2 fournit à partir du succinyl-CoA une liaison riche supplémentaire, ce qui porte à douze le nombre total de molécules d’ATP synthétisées lors de l’oxydation d’un radical acétyle par le cycle tricarboxylique. C’est la source fondamentale d’énergie pour toute cellule.
3. Bilan énergétique de l’oxydation complète du glucose. En tenant compte de ce qui a été exposé dans l’article GLUCIDES, on est en mesure de faire l’inventaire de toutes les molécules d’ATP formées au cours de l’oxydation aérobie complète du glucose. Ce bilan est dressé dans la figure 7.
Puisque l’énergie libre fournie par l’oxydation du glucose est de 686 kcal:

et que la synthèse de chacune des 38 molécules d’ATP formées nécessite un apport minimal de 7 kcal/mole, le rendement théorique approximatif de la conservation de l’énergie est donc:

Il est probable que, dans la cellule intacte, ce rendement dépasse largement 60 p. 100.
L’équation (d) permet de tirer deux conclusions:
– La suite de la dégradation des glucides consiste en des oxydations qui, à leur terme, donnent de l’anhydride carbonique et de l’eau, caractéristiques de la respiration [cf. RESPIRATION].
– L’énergie chimique potentielle contenue dans les aliments (glucides, lipides, protides), et dont la source chez les êtres vivants est représentée par les différentes radiations solaires et l’assimilation chlorophyllienne [cf. PHOTOSYNTHÈSE], est convertie en partie par les cellules, suivant le principe de la conservation de l’énergie, en une forme de réserve facilement utilisable: l’ATP. Cette énergie sera utilisée pour la régulation thermique, le travail mécanique et les biosynthèses, ce qui implique que l’organisme a des besoins et des dépenses d’énergie et de matière [cf. NUTRITION].
Dans tous les tissus, la respiration cellulaire est donc à l’origine de la chaleur animale, mise en évidence par l’expérience de Lavoisier. On comprend alors pourquoi l’abaissement de la température ambiante, le travail musculaire, la digestion, la croissance et, en général, toutes les activités de l’organisme entraînent une augmentation de la dépense d’énergie. Par exemple, pour lutter contre le froid, l’homme met en jeu des régulations mécaniques (contractions musculaires involontaires) et chimiques (stimulation des oxydations cellulaires); la croissance nécessite un apport supplémentaire d’énergie pour déclencher toutes les réactions d’anabolisme.
L’alimentation du système métabolique central
Le système métabolique central reçoit des petites molécules issues du catabolisme des glucides, des lipides et des protéines (fig. 8).
Catabolisme glucidique
La glycolyse, conduisant du glucose à l’acide pyruvique, alimente le système métabolique central en fournissant, d’une part, de l’acétyl-coenzyme A par oxydation du pyruvate sous l’influence de la pyruvate-oxydase qui catalyse la réaction (5) – ce système multienzymatique fonctionne comme celui de l’ 見-cétoglutarate-oxydase –; d’autre part, de l’oxaloacétate à partir du pyruvate, par la réaction de carboxylation (6).
Catabolisme lipidique
La dégradation des acides gras à nombre pair d’atomes de carbone par 廓-oxydation conduit à la formation d’acétyl-coenzyme A incorporable dans le cycle de Krebs et à la réduction, à chaque tour de spire de l’hélice de Lynen, de FAD et de NAD+ qui alimentent aussi les chaînes respiratoires.
La dégradation des acides gras à nombre impair d’atomes de carbone fournit, en plus de l’acétyl-CoA, du propionyl-CoA, qui rejoint le succinyl-CoA grâce aux réactions (7).
Catabolisme protéique
Les acides aminés sont convertis à différents niveaux au cours de leur catabolisme en molécules constitutives du système métabolique central. Les diverses réactions ont été groupées dans la figure 8, à partir de laquelle on peut dégager les notions suivantes: par transamination puis désamination, le catabolisme des acides aminés alimente les carrefours pyruvique et acétyl-CoA, et fournit de plus des substrats au cycle citrique. Inversement, du fait de la réversibilité de la transamination, la synthèse d’acides aminés est possible à partir du système métabolique central, montrant le rôle de carrefour de ce dernier dans les différents métabolismes.
Le rôle biosynthétique du système métabolique central
Les substrats du cycle de Krebs, ainsi que l’énergie formée au cours de la phosphorylation oxydative, sont utilisés pour les synthèses des glucides, des lipides, des porphyrines, des acides aminés, des protéines, des nucléotides et des acides nucléiques (fig. 8).
Glucides (disaccharides et polysaccharides)
La formation des liaisons osidiques nécessite de l’énergie. C’est pour cette raison qu’au cours de la biosynthèse des glucides le glucose doit être activé en deux temps: d’abord formation de glucose-1-phosphate à partir de l’ATP; le glucose-1-phosphate, sous l’action de l’uridine triphosphate (UTP), donne naissance à l’uridine diphosphoglucose (UDP-glucose); ensuite, transfert des restes glucosyls de l’UDP-glucose sur un accepteur, molécule de glycogène préformé de préférence, pour former des chaînes de glucose liées en 見 (14) dans le cas du glycogène [cf. GLUCIDES].
Lipides
Biogenèse des acides gras
Les acides gras sont des constituants de toute cellule vivante, et la plupart d’entre eux sont synthétisés dans les cellules elles-mêmes, à partir de composés organiques très simples: glucose, acide pyruvique, acides aminés. Cependant, les possibilités de synthèse sont extrêmement variées selon les espèces. D’une façon générale, leur biogenèse n’est pas le processus inverse de la 廓-oxydation; elle débute par l’apparition du malonyl-CoA, qui provient de la carboxylation de l’acétyl-CoA en présence d’ATP et d’une enzyme à biotine. Une série de réactions (condensation, réduction, déshydratation) conduit finalement à l’acide gras (cf.métabolisme des acides GRAS).
Biogenèse des triglycérides et des phospholipides
La phosphorylation du glycérol ou la réduction du dihydroxyacétone-phosphate, produit intermédiaire de la glycolyse, aboutit à l’ 見-glycérophosphate. La condensation de l’ 見-glycérophosphate et de deux molécules d’acides gras activés donne un diglycéridephosphate; après déphosphorylation de ce composé, on se trouve devant deux grandes voies métaboliques, conduisant respectivement aux phospholipides et aux triglycérides [cf. LIPIDES].
Biogenèse des stéroïdes
Les stéroïdes sont des substances lipoïdiques dont la structure et la fonction diffèrent de celles des triglycérides. Dans ce groupe figurent des composés apparentés au cholestérol, à la vitamine D, aux hormones stéroïdes. Au cours de la biosynthèse du cholestérol, par exemple, l’acétyl-CoA est la source de tous les atomes de carbone. À travers toute une série de réductions, d’isomérisations, on obtient d’abord le squalène qui se cyclise pour former le noyau caractéristique des stérols [cf. LIPIDES].
Porphyrines
La biosynthèse des porphyrines se fait par condensation du succinyl-CoA avec le glycocolle (cf. PIGMENTS ET PIGMENTATION, PORPHYRINES ET PORPHYRIES).
Acides aminés
Sans entrer dans les détails, on mentionnera ici l’origine métabolique de quelques acides aminés. L’arginine est un intermédiaire du cycle de l’urée. Le glutamate est issu de l’amination réductrice de l’ 見-cétoglutarate. La sérine, l’alanine et l’aspartate résultent de la transamination de l’acide hydroxypyruvique. La sérine peut être interconvertie, soit en glycocolle et en une unité à un carbone qui est captée par l’acide tétrahydrofolique (transporteur d’unités monocarbonées), soit en cystéine. La proline a pour origine le glutamate. Le noyau imidazole de l’histidine emprunte ses éléments au ribose, à l’adénine et à la glutamine. Enfin, le tryptophane, la phénylalanine et la tyrosine dérivent de l’acide shikimique (cf. AMINO-ACIDES, biosynthèse des composés PHÉNOLIQUES).
Protéines
Les protéines sont des macromolécules composées par l’enchaînement de plusieurs acides aminés suivant une séquence bien définie. Pour entrer dans la constitution de la protéine, chaque acide aminé doit être activé par des enzymes en formant des complexes du type acide aminé-adénylate (AA 黎 AMP), dans lesquels le groupement carboxyle de l’acide aminé est relié par une liaison riche en énergie (symbolisée par 黎) à un groupement adénylique, AMP. Ensuite, l’AA 黎 AMP réagit avec une molécule d’ARN de transfert (ARNt) spécifique de cet acide amidé. Celui-ci, une fois combiné à l’ARNt (AA 黎 ARNt), diffuse vers les ribosomes. Là, il s’attache en un point bien déterminé de l’ARN messager (ARNm), porteur du code génétique. Une liaison peptidique s’établit enzymatiquement entre les deux premiers acides aminés fixés sur l’ARNm, et on obtient un dipeptide. Ce processus d’additions successives d’acides aminés se reproduit un grand nombre de fois jusqu’à formation d’une chaîne complète. La protéine quitte alors le ribosome et acquiert une structure caractéristique (cf. BIOLOGIE MOLÉCULAIRE, PROTÉINES).
Nucléotides puriques et pyrimidiques
Les nucléotides jouent un rôle important dans l’organisme puisqu’ils entrent dans la constitution des coenzymes telles que l’ATP, le NAD +, le FAD. Suivant la nature de la base qui les constitue, on distingue deux types de nucléotides:
– Les nucléotides puriques sont synthétisés dans la cellule par une série complexe de réactions qui impliquent l’incorporation d’atomes émanant de sources diverses: ribose-5-phosphate, ATP, glycocolle, formyl-tétrahydrofolate, gaz carbonique. Le groupement carboxyle est amidifié par l’azote de l’acide aspartique. Le premier dérivé purique formé est l’acide inosinique.
– Les nucléotides pyrimidiques requièrent pour leur synthèse du ribose-5-phosphate, de l’ATP, du carbamyl-phosphate et de l’aspartate. Le premier nucléotide pyrimidique qui apparaît est l’orotidine monophosphate (cf. métabolisme des PURINES ET PYRIMIDINES).
Acides nucléiques
L’ADN polymérase catalyse la synthèse de l’ADN à partir des triphosphates des quatre nucléotides: désoxyadénosine-triphosphate, désoxyguanosine-triphosphate, désoxycytidine-triphosphate et thymidine-triphosphate. Outre ces quatre désoxyribonucléoside-triphosphates, figure nécessairement une petite quantité d’ADN, de haut poids moléculaire, qui «initie» la synthèse et joue le rôle de matrice.
La biosynthèse des ARN se réalise dans la cellule au moins en partie à proximité même du chromosome. Elle a besoin, non seulement de quatre nucléotide-triphosphates (ATP, GTP, CTP et UTP) comme substrat et d’une ARN polymérase, mais encore d’un ADN initiateur qui possède la fonction de matrice et sur lequel les nucléotides s’ordonnent (cf. BIOLOGIE MOLÉCULAIRE, acides NUCLÉIQUES).
Formation des acides dicarboxyliques
Ces synthèses appauvriraient rapidement les cellules en intermédiaires du cycle, si des réactions de carboxylation n’assuraient pas la formation d’acides dicarboxyliques à partir des substrats fournis par la glycolyse: c’est notamment le cas du pyruvate, source d’oxaloacétate et de malate. Deux systèmes enzymatiques interviennent:
– La pyruvate-carboxylase, enzyme intramitochondriale ayant la biotine comme coenzyme, catalyse la formation d’oxaloacétate selon la réaction (8). L’enzyme est activée par l’acétyl-CoA et inhibée par le citrate et l’ATP, grâce à un mécanisme allostérique.
– L’enzyme malique, extramitochondriale, dont la coenzyme est NADP+, catalyse réversiblement la décarboxylation oxydative du L-malate en pyruvate selon la réaction (9).
Ainsi, tant dans la mitochondrie qu’en dehors d’elle, ces réactions de carboxylation, comme l’indique la figure 9, fournissent des substrats du cycle citrique, dont certains peuvent franchir la membrane mitochondriale.
Grâce à ces transferts, les relations entre cycle citrique et néoglycogenèse peuvent s’établir, notamment au niveau du foie et du rein [cf. GLUCIDES]. Dans ces organes, le phospho-énol-pyruvate (PEP), précurseur du glucose, prend naissance à partir de l’oxalo-acétate formé tant dans la mitochondrie par la réaction (8) que dans le cytoplasme par la réaction (9) couplée avec l’oxydation du malate. La décarboxylation de l’oxaloacétate est catalysée par la phospho-énol-pyruvate-carboxykinase en présence de nucléotides inosiniques ou guanyliques selon la réaction (10).
Les deux enzymes, pyruvate-carboxylase et phospho-énol-pyruvate-carboxylase, dont le cortisol est l’inducteur physiologique, interviennent dans la première étape de la néoglycogenèse, que l’on peut représenter dans les réactions (11).
La figure 8 montre le rôle biosynthétique du cycle de Krebs et ses interrelations métaboliques.
La régulation
La régulation de ce système biologique orienté vers l’anabolisme ou le catabolisme est un mécanisme harmonieux qui a pour objectif d’éviter l’accumulation intratissulaire des métabolites de l’acétyl-coenzyme A et notamment des intermédiaires du cycle: leur concentration dans les organes et dans le sang ne varie physiologiquement que dans d’étroites limites. La régulation se fait à différents niveaux et selon des modalités différentes que nous décrirons analytiquement.
Au niveau de l’acétyl-coenzyme A
L’acétyl-coenzyme A est un carrefour métabolique; il peut soit entrer dans le cycle de Krebs pour être dégradé en C2 et H2O, soit être aiguillé vers les voies biosynthétiques, notamment vers la synthèse des acides gras (fig. 10). L’orientation vers l’une ou l’autre voie est influencée par les concentrations des substrats du cycle tricarboxylique: leur diminution favorise l’action de la citrate-synthétase, donc l’oxydation de l’acétyl-CoA; leur augmentation active l’acétyl-CoA-carboxylase, de sorte que c’est la biosynthèse des acides gras qui est stimulée.
De plus, les acyl-CoA à longue chaîne inhibent à la fois l’acétyl-CoA-carboxylase et la citrate-synthétase; cette inhibition simultanée peut jouer un rôle dans le déterminisme de la cétose, qui apparaît lorsque la teneur hépatique en acyl-coenzyme A augmente: la formation des corps cétoniques est la seule voie métabolique non inhibée.
Au niveau de la pyruvate-carboxylase
La pyruvate-carboxylase est la première enzyme de la néoglycogenèse à partir du pyruvate. L’acétyl-CoA est à la fois l’activateur allostérique de cette enzyme et l’inhibiteur de la pyruvate-oxydase. C’est dire l’importance de la lipolyse comme facteur régulateur du carrefour pyruvique, orientant le destin de cet acide 見-cétonique soit vers la néoglycogenèse, soit vers sa dégradation oxydative par le cycle de Krebs. Notons que le cortisol est l’inducteur de la biosynthèse des enzymes de la néoglycogenèse: pyruvate-carboxylase et phospho-énol-pyruvate-carboxykinase.
Ces régulations, de nature allostérique, mises en jeu au niveau des premières enzymes de voies métaboliques: acétyl-CoA-carboxylase, citrate-synthétase, pyruvate-carboxylase, montrent à quel point la synthèse des acides gras est influencée par les intermédiaires du cycle tricarboxylique.
Au niveau du rapport ATP/ADP
Ces régulations allostériques sont complétées par celles qu’exerce la nécessité pour la cellule de maintenir la constance du rapport ATP/ADP. Une augmentation de l’ADP, donc une diminution du rapport, favorise la déshydrogénation de l’isocitrate par l’enzyme à NAD+ et, par suite, le déroulement du cycle tricarboxylique; à la réduction accrue du NAD+ s’ajoute une accélération de la vitesse de fonctionnement des chaînes d’oxydoréduction, ayant pour objectif la formation d’ATP et donc le retour du rapport ATP/ADP à un niveau normal. Inversement, l’augmentation du rapport ATP/ADP favorise la déshydrogénation de l’isocitrate, mais avec production extramitochondriale de NADPH2, ce qui accélérera les biosynthèses et consommera de l’ATP.
Au niveau du rapport NAD+/NADH2
De même, les rapports extra- et intra-mitochondriaux NAD+/NADH2 influencent le destin des substrats du cycle, les orientant vers les oxydations génératrices d’hydrogène ou vers les synthèses qui en consomment, de façon à maintenir de part et d’autre de la membrane mitochondriale des rapports adaptés aux exigences de la vie cellulaire. En plus de ces deux types de mécanismes régulateurs, il faut faire une place à l’inhibition de l’oxydation du succinate par l’oxaloacétate, ou bien compétitive, ou actuellement attribuée à une transition d’une forme active à une forme inactive de la succino-déshydrogénase en présence d’oxaloacétate.
L’unité du monde vivant
Ce système métabolique central, dont la structure et le rôle ont été étudiés dans les cellules animales, existe également chez les micro-organismes et chez les végétaux supérieurs. Pour les plantes qui utilisent les graisses de réserve pour des synthèses, ainsi que pour les micro-organismes dont la croissance dépend de la fourniture d’acides gras ou dont l’acide acétique est la source exclusive de carbone, le système métabolique central est complété par le cycle glyoxylique, variante du cycle de Krebs, avec lequel il coexiste (fig. 2). On note que deux processus biochimiques se surajoutent au cycle classique:
– le clivage de l’isocitrate, sous l’influence de l’isocitritase, en succinate et glyoxylate;
– la condensation du glyoxylate avec l’acétyl-CoA pour former du malate, grâce à la malate-synthétase.
Le résultat net est la conversion en succinate de deux moles d’acétate activé: c’est là la différence entre le cycle de Krebs, qui à partir de l’acétate produit de l’énergie, et le cycle glyoxylique qui, à partir du même acétate, synthétise des acides dicarboxyliques à quatre atomes de carbone. Cette différence permet d’expliquer que, contrairement aux animaux, les végétaux et les micro-organismes peuvent synthétiser du glucose à partir des acides gras (néoglycogenèse). Le cycle glyoxylique est régulé lui aussi au niveau de l’isocitritase qui est inhibée par le succinate et l’oxaloacétate. Cette inhibition s’oppose à la surproduction d’acides dicarboxyliques à quatre carbones. De même, la synthèse de constituants cellulaires à partir de ces acides supprime l’inhibition de l’isocitritase. Cette enzyme a, de plus, la particularité d’être inductible par l’acétate, qui lève la répression exercée par le phospho-énol-pyruvate sur la biosynthèse de cette enzyme.
Ainsi, dans le monde vivant, l’unité est évidente: ce sont des mécanismes identiques qui président à la production de substrats dont l’ensemble cyclique forme «un même système métabolique central». Les mécanismes régulateurs s’exerçant au niveau des enzymes sont superposables: induction ou répression de leur synthèse et adaptation de leur activité aux besoins cataboliques ou anaboliques des cellules.
métabolisme [ metabɔlism ] n. m.
• 1858 chim.; du gr. metabolê « changement »
♦ Physiol. Ensemble des transformations chimiques et physicochimiques qui s'accomplissent dans tous les tissus de l'organisme vivant (dépenses énergétiques, échanges, nutrition...). Phénomènes d'assimilation (⇒ anabolisme) , de dégradation (⇒ catabolisme) du métabolisme. Le métabolisme des glucides. — Métabolisme basal ou de base : quantité de chaleur que produit, par heure et par mètre carré de la surface du corps, un sujet à jeun et au repos.
● métabolisme nom masculin (grec metabolê, de metaballein, transformer) Ensemble des processus complexes et incessants de transformation de matière et d'énergie par la cellule ou l'organisme, au cours des phénomènes d'édification et de dégradation organiques (anabolisme et catabolisme).
métabolisme
n. m. BIOL Ensemble des réactions biochimiques qui se produisent au sein de la matière vivante et par lesquelles certaines substances s'élaborent (anabolisme) ou se dégradent en libérant de l'énergie (catabolisme).
|| MED Métabolisme de base ou basal: quantité de chaleur produite par un sujet à jeun et au repos, par heure et par mètre carré de la surface du corps.
⇒MÉTABOLISME, subst. masc.
PHYSIOL. Ensemble des réactions de synthèse, génératrices de matériaux (anabolisme), et de dégradation, génératrices d'énergie (catabolisme), qui s'effectuent au sein de la matière vivante à partir des constituants chimiques fournis à l'organisme par l'alimentation et sous l'action de catalyseurs spécifiques. Abaissement, régulation du métabolisme; déchets du métabolisme. Le métabolisme est plus intense chez l'enfant que chez l'adulte, chez les petits animaux que chez les grands animaux (CARREL, L'Homme, 1935, p. 94). Les traceurs radioactifs (...) permettent d'étudier sur les organismes vivants le métabolisme (GOLDSCHMIDT, Avent. atom., 1962, p. 230). V. anabolisme ex. 1.
— [Avec déterm.] Métabolisme normal.
♦[Le déterm. désigne l'organisme ou l'organe concerné] Métabolisme cérébral, microbien. Le métabolisme des diverses espèces bactériennes engendre, à partir du même milieu, des produits de déchet différents (PLANTEFOL, Bot. et biol. végét., t. 2, 1931, p. 33). Il est possible en modifiant le métabolisme des cellules cérébrales d'améliorer le rendement intellectuel (DELAY, Psychol. méd., 1953, p. 222). Les virus à ARN provoquent une augmentation du métabolisme du nucléole et du cytoplasme périnucléaire (Hist. gén. sc., t. 3, vol. 2, 1964, p. 627). V. anabolisme ex. 3.
♦[Le déterm. désigne la fonction concernée] Métabolisme de croissance. Fréquemment, les champignons utilisent pour leur métabolisme respiratoire des substances dissoutes dans le milieu où ils se développent (PLANTEFOL, Bot. et biol. végét., t. 1, 1931, p. 285).
♦[Le déterm. désigne la substance concernée] Des expériences sont en cours (...) de façon à essayer de déceler les stades successifs du métabolisme du carbone aboutissant à la formation de molécules complexes indispensables à la vie (GOLDSCHMIDT, Avent. atom., 1962, p.236). Le rôle essentiel joué par le corps thyroïde dans le métabolisme de l'iode suggère l'importance de cette substance dans la formation de l'hormone thyroïdienne (QUILLET Méd. 1965, p.471). On (...) trouve [la vitamine B6 ou pyridoxine] présente et active dans le métabolisme des sucres, des lipides et des protides (R. SCHWARTZ, Nouv. remèdes et mal. act., 1965, p. 68).
♦[Le déterm. désigne un aspect particulier du processus]
Métabolisme intermédaire. Ensemble des réactions qui assurent la jonction entre les mécanismes de synthèse et les mécanismes de dégradation (d'apr. Physiol., 1969, p. 90 [Encyclop. de la Pléiade]). Ce métabolisme intermédiaire consiste en une suite d'opérations rapides s'effectuant à la température du corps grâce aux enzymes qui jouent le rôle de catalyseurs (Hist. gén. sc., t. 3, vol. 2, 1964, p. 616). [Les ] réactions du métabolisme intermédiaire sont le plus souvent des réactions d'équilibre dont la réversibilité dépend de la vitesse de formation des différents partenaires (Physiol., 1969, p. 97 [Encylop. de la Pléide]).
Métabolisme basal/de base. Métabolisme minimal compatible avec le maintien des fonctions vitales, correspondant à la quantité de chaleur, exprimée en calories, produite en une heure et par mètre carré de surface corporelle chez un individu à jeun, au repos et en équilibre thermique avec l'extérieur. Calcul, étude, mesure du métabolisme de base. Chez les basedowiens, le métabolisme basal serait augmenté du tiers dans les cas légers, de la moitié dans les cas moyens et du double dans les cas graves (SOUQUES ds Nouv. Traité Méd. fasc. 8 1925, p. 209). Atwater (en 1899), Lefèvre (en 1900), (...) précisent la notion de métabolisme basal, c'est-à-dire du minimum d'énergie nécessaire au fonctionnement vital: respiration, circulation, etc., sans dépense extérieure d'aucune sorte (R. LALANNE, Alim. hum., 1942, p. 38). V. basal ex.
REM. Métabolisant, -ante, adj. Qui intervient dans le métabolisme. Les hormones métabolisantes gouvernent l'équilibre chimique du milieu intérieur (Hist. gén. sc., t. 3, vol. 2, 1964, p. 649).
Prononc.:[ ]. Étymol. et Hist. 1. 1858 physiol. (NYSTEN); 2. métabolisme basal, v. basal. Dér. du gr.
]. Étymol. et Hist. 1. 1858 physiol. (NYSTEN); 2. métabolisme basal, v. basal. Dér. du gr.  , v. métabole1; suff. -isme. Fréq. abs. littér.:30.
, v. métabole1; suff. -isme. Fréq. abs. littér.:30.
 ]. Étymol. et Hist. 1. 1858 physiol. (NYSTEN); 2. métabolisme basal, v. basal. Dér. du gr.
]. Étymol. et Hist. 1. 1858 physiol. (NYSTEN); 2. métabolisme basal, v. basal. Dér. du gr.  , v. métabole1; suff. -isme. Fréq. abs. littér.:30.
, v. métabole1; suff. -isme. Fréq. abs. littér.:30.
métabolisme [metabɔlism] n. m.
ÉTYM. 1858, chim.; grec metabolê « changement ».
❖
♦ (Déb. XXe). Physiol. Ensemble des transformations chimiques et physico-chimiques qui s'accomplissent dans tous les tissus de l'organisme vivant (dépenses énergétiques, échanges, nutrition…). || Phénomènes d'assimilation du métabolisme. ⇒ Anabolisme. || Phénomènes de dégradation du métabolisme. ⇒ Catabolisme. || Intensité du métabolisme. ⇒ Échange. || Activateurs du métabolisme. || Qui diminue le métabolisme. ⇒ Antimétabolique, antimétabolite. || Analyse, mesure du métabolisme. — (XXe). || Métabolisme basal ou de base : quantité de chaleur que produit, par heure et par mètre carré de la surface du corps, un sujet à jeun et au repos.
1 On mesure le métabolisme par la quantité d'oxygène absorbé et celle d'acide carbonique dégagé, quand le corps se trouve à l'état de repos complet. Dès que les muscles se contractent et produisent un travail mécanique, l'activité des échanges s'élève beaucoup (…) Chose curieuse, le travail intellectuel ne produit aucune élévation du métabolisme (…) Les plus puissantes créations de l'intelligence augmentent beaucoup moins le métabolisme que le muscle biceps quand il se contracte pour soulever un poids d'une livre.
Alexis Carrel, l'Homme, cet inconnu, III, VI.
2 Les êtres vivants sont des machines chimiques. La croissance et la multiplication de tous les organismes exigent que soient accomplies des milliers de réactions chimiques grâce à quoi sont élaborés les constituants essentiels des cellules. C'est ce qu'on appelle le « métabolisme ». Ce métabolisme est organisé en un grand nombre de « voies », divergentes, convergentes ou cycliques, comprenant chacune une séquence de réactions. L'orientation précise et le rendement élevé de cette énorme et microscopique activité chimique sont assurés par une certaine classe de protéines, les enzymes, jouant le rôle de catalyseurs spécifiques.
Jacques Monod, le Hasard et la Nécessité, p. 67.
❖
DÉR. Métabolisation, métabolite.
Encyclopédie Universelle. 2012.