MAGNÉSIUM
Le magnésium est un élément chimique métallique de symbole Mg et de numéro atomique 12. C’est le plus léger des métaux structuraux. Le nom de magnésium vient probablement de celui d’une bourgade d’Asie Mineure, Magnesia, bien connue plusieurs siècles avant notre ère pour sa magnésie blanche. Qu’ils soient sous forme d’oxyde, de carbonate, de chlorure ou de sulfate, les minerais de magnésium sont très répandus sur la Terre. Le métal ne s’y rencontre pas à l’état natif, son activité chimique extrêmement grande ne le permet pas. Il a fallu l’électrolyse ignée ou l’emploi de réducteurs très énergiques à des températures élevées pour parvenir à réduire le chlorure et, à une date plus récente, l’oxyde de magnésium.
C’est l’affinité toute particulière pour l’oxygène qui domine les propriétés chimiques en milieu aqueux ou à haute température. La résistance à la corrosion est influencée de façon très sensible par la teneur en impuretés; le fer et le nickel, en particulier, augmentent considérablement la vitesse d’attaque par l’eau ou les réactifs chimiques dilués. L’addition du zirconium joue un rôle très remarquable; son application systématique, dans ces trente dernières années, a provoqué un renouveau dans la métallurgie du magnésium. La recherche de l’amélioration de ses propriétés mécaniques à la température ambiante ou à chaud a conduit à préparer des alliages avec l’aluminium, puis le zinc et, tout récemment, le thorium et les métaux des terres rares (lanthanides).
Les applications mécaniques du magnésium sont dominées par sa faible densité qui a conduit à appeler ses alliages «ultra-légers». C’est aussi un des matériaux qui se prête le mieux à l’usinage à très grande vitesse.
Dans la métallurgie des métaux nouveaux (uranium, titane, zirconium), il apparaît comme un réducteur efficace et dont l’oxyde est facile à éliminer. Les développements nouveaux auxquels il peut donner une solution compétitive font appel, en fait, à la coexistence de plusieurs propriétés diverses. La faible section de capture des neutrons thermiques, jointe à la résistance à l’oxydation par le gaz carbonique à température élevée et pendant des temps longs, a permis une application importante dans le domaine nucléaire. Sa capacité d’amortissement mécanique jointe à son grand volume spécifique peut, dans l’avenir, apporter une solution originale à des problèmes de lutte contre le bruit.
En dehors de son importance technique, le magnésium joue un rôle fondamental dans les phénomènes chimiques qui accompagnent toute vie, et ce aussi bien chez les êtres unicellulaires que pluricellulaires. Il entre, en effet, dans la constitution de la chlorophylle, pigment qui permet aux végétaux verts de transformer l’énergie solaire en acide adénosine triphosphorique (ATP) nécessaire à la synthèse de molécules organiques, telles que les glucides, lipides, protéines... En outre, ce métal est un activateur de certaines enzymes qui interviennent dans le métabolisme.
1. Métallurgie
Minerais
Le magnésium représente 2 p. 100 des éléments qui constituent l’écorce terrestre et il vient au huitième rang par ordre d’importance. On le rencontre dans les roches magmatiques, sédimentaires et métamorphiques, généralement sous forme de carbonates, d’hydroxyde, de silicates, de chlorure et de sulfate. Les minerais les plus fréquemment utilisés sont: le carbonate (magnésite ou giobertite) pratiquement pur (Autriche, ex-U.R.S.S., Grèce, Chine, États-Unis); le carbonate double de calcium et de magnésium (dolomite) qui se trouve dans un grand nombre de pays; la carnallite, un chlorure double de magnésium et de potassium cristallisé avec six molécules d’eau (plutôt utilisé comme source de potassium). L’eau de mer qui contient, sous forme de chlorure, 1,3 kg de magnésium par mètre cube en constitue une réserve immense; certaines mers fermées ou certains lacs peuvent en contenir jusqu’à 35 kg/m3.
À la suite des travaux de H. Sainte-Claire Deville et de O. Caron (1857), la réduction chimique du chlorure de magnésium a été la première méthode industrielle employée pour produire le métal. À la fin du XIXe siècle, cette méthode a été complètement abandonnée et remplacée par le procédé électrolytique de Bunsen. Enfin, plus récemment, est apparu un troisième procédé: la réduction à haute température et sous atmosphère protectrice (vide) de la magnésie par un réducteur industriel. Le procédé électrolytique et la réduction de la magnésie MgO à haute température sont en compétition, les facteurs économiques locaux faisant pencher vers l’une ou vers l’autre de ces deux voies.
Électrolyse ignée
Le procédé I. G. Farbenindustrie a été employé jusqu’en 1945. Il consiste essentiellement à réduire le carbonate de magnésium à chaud par le chlore gazeux en présence de carbone. Le chlorure de magnésium fondu obtenu est introduit directement dans les cuves d’électrolyse. Celles-ci sont des caissons parallélépipédiques cloisonnés par des diaphragmes en céramique. Autour des anodes en graphite, on recueille le chlore qui est renvoyé au four de réduction du carbonate. Le compartiment cathodique est en matériau réfractaire, il permet de recueillir par siphonage le magnésium liquide. Une cuve fonctionnant à 25 000 ampères, sous 6 à 8 volts, produit 220 kilogrammes de métal par vingt-quatre heures.
Dans le procédé de la Dow Chemical Company , exploité actuellement aux États-Unis dans le golfe du Mexique, le magnésium est extrait de l’eau de mer. Celle-ci est pompée à travers des filtres et envoyée avec un lait de chaux dans un bassin de floculation où l’hydroxyde Mg(OH)2 précipite. Il est ensuite recueilli sur filtre, puis repris par une solution d’acide chlorhydrique. Le chlorure de magnésium formé est évaporé et déshydraté partiellement (jusqu’à la concentration correspondant à la formule MgCl2, 1,25 H2O, en fait). C’est ce produit qui alimente les cuves d’électrolyse. Celles-ci sont en acier et constituent les cathodes. Comme dans le procédé I. G. Farben, les anodes sont en graphite, mais, dans ce cas, elles subissent une usure plus importante due à l’oxydation par l’eau contenue dans le chlorure. Le chlore recueilli à l’anode est transformé en acide chlorhydrique qui rentre dans le cycle. Les cuves sont alimentées par un courant de 40 000 à 80 000 ampères sous 6 à 7 volts. Elles produisent 500 kilogrammes de métal par vingt-quatre heures, soit une dépense moyenne de 21 kWh par kilogramme de métal produit.
Le procédé Norsk Hydro , exploité en Norvège, est une combinaison des deux précédents. Le magnésium de l’eau de mer est précipité par la dolomie calcinée, de telle sorte que, finalement, la moitié de la magnésie recueillie sur les filtres provient de l’eau de mer et l’autre moitié de la dolomie. L’hydroxyde est séché et calciné en oxyde. Comme dans le procédé I. G. Farben, l’oxyde est réduit en chlorure fondu qui est électrolysé.
Réduction thermique
Malgré sa chaleur de formation élevée, la magnésie peut être réduite par des agents énergétiques. Cette réaction est fortement endothermique et ne peut se produire qu’au-dessus d’une certaine température qui dépend du réducteur employé. Pour favoriser le déplacement de l’équilibre dans le sens de la réduction, il faut apporter de l’énergie sous forme de chaleur et éliminer le magnésium au fur et à mesure de sa formation. On met à profit, dans les différents procédés, la forte tension de vapeur du magnésium vers 1 100 0C.
De nombreux procédés ont été imaginés et parfois mis en œuvre. Ceux qui font intervenir le carbone, l’aluminium, le carbure de calcium ont tous été abandonnés pour des raisons de sécurité ou d’économie. Seul, actuellement, le silicium est utilisé industriellement dans deux procédés.
Procédé Pidgeon
La réduction par le silicium contenu dans le ferrosilicium présente l’avantage de pouvoir s’appliquer directement à la dolomie calcinée, suivant la réaction:

et la silice formée est immédiatement saturée par la chaux de la dolomie pour former un silicate de calcium. Le mélange de dolomie calcinée et broyée et de ferrosilicium à 75 p. 100 est aggloméré en briquettes qui sont chargées dans des batteries de cornues cylindriques en acier réfractaire au chrome-nickel. Ces briquettes sont chauffées dans un four à gaz à 1 150 0C, où un vide de 0,1 torr est maintenu. L’extrémité de chaque cornue dépasse du four et sert de condenseur. La charge de 150 kg de briquettes par cornue est réduite en huit heures et donne environ 30 kg de magnésium qu’il faut refondre. Ce procédé a été utilisé notamment aux États-Unis, au Canada et en Grande-Bretagne. Il l’est encore au Japon et en Italie avec des variantes. Des études très poussées ont été faites sur ce procédé dans divers pays pour le perfectionner et le rendre continu. Différents appareillages ont été proposés: four tournant horizontal chauffé par une électrode axiale en carbone, four vertical à résistance interne, four à induction, etc.
Procédé Magnétherm
En France, une usine pilote située à Beaudéan (Hautes-Pyrénées) a poursuivi pendant plus de dix ans l’étude et le perfectionnement du procédé de réduction de la dolomie par le ferrosilicium. Ces efforts ont abouti à la mise au point du procédé Magnétherm, exploité à l’usine de Marignac (Haute-Garonne) depuis 1964. À la différence du procédé Pidgeon original, dans lequel la réduction a lieu entièrement en phase solide et où le magnésium est recueilli à l’état solide sous forme d’agrégats cristallins, le procédé Magnétherm est essentiellement caractérisé par les deux points suivants: la réduction se fait intégralement en phase liquide en employant la bauxite comme fondant pour former un laitier fusible qui est récupéré ainsi que le ferrosilicium résiduaire; le magnésium produit est condensé et recueilli à l’état liquide. La réduction est effectuée dans un four électrique monophasé vertical maintenu sous pression réduite. Les matières premières: dolomie, bauxite et ferrosilicium, y sont introduites sous une forme soigneusement calibrée et selon un programme prédéterminé. La présence de bauxite ou d’alumine permet d’obtenir un laitier de silico-aluminates de chaux qui est liquide au-dessus de 1 400 0C. Ce laitier, parfaitement stable, est utilisé comme thermistor pour apporter les calories nécessaires à le maintenir liquide et pour compenser celles absorbées par la réaction endothermique. Le magnésium produit est recueilli à l’état liquide dans un creuset fixé à la partie inférieure d’un condenseur spécialement conçu. Périodiquement, le four est remis à la pression atmosphérique, d’une part, pour séparer le creuset contenant le magnésium produit et, d’autre part, pour évacuer le laitier en excès et une partie du ferrosilicium résiduaire.
Les unités de production sont actuellement de 3 et de 6,5 t par vingt-quatre heures. Elles consomment 12 kWh par kilogramme de métal produit. Le procédé Magnétherm représente un gros progrès par rapport au procédé Pidgeon original, parce qu’il fonctionne en continu et qu’il évite le broyage fin des matières premières ainsi que leur conditionnement sous forme de pastilles ou de briquettes. De plus, le métal étant recueilli liquide, il évite une refusion. Il faut encore remarquer que ce procédé se prête particulièrement bien aux extensions successives, ce qui permet d’adapter les investissements au développement du marché, que l’atelier de production occupe une surface au sol relativement faible par tonne de magnésium produite et que, pour un même tonnage, les investissements sont moins importants que dans les procédés électrolytiques.
2. Alliages
Propriétés mécaniques
Le magnésium est très malléable, ductile mais peu tenace. Pour améliorer ses propriétés d’usage dans des domaines précis, on a créé des alliages, que l’on peut regrouper en plusieurs familles correspondant, du reste, à l’évolution chronologique. Les premiers mis au point sont encore considérés comme les alliages classiques et rencontrés dans de très fréquentes applications. Ils contiennent essentiellement de l’aluminium et du zinc. Une addition faible de manganèse améliore leur propriétés mécaniques et leur résistance à la corrosion. Plus récemment, on a découvert le rôle remarquable de l’addition de zirconium: en structure de solidification, et également après déformation plastique par forgeage, laminage ou extrusion, la présence de zirconium provoque un affinement du grain. Cette propriété se conserve à chaud, même après des séjours de très longue durée à haute température. À partir de cette base (de 0,3 à 0,7 p. 100 de zirconium), une addition de zinc a permis de développer des alliages à moyenne ou haute résistance mécanique à température ambiante et dont la plasticité est relativement élevée.
L’addition de thorium, de lanthanides ou d’argent permet de maintenir les propriétés mécaniques mesurées à chaud. Ces éléments sont compatibles avec le zirconium, et les propriétés spécifiques des deux types d’addition sont cumulatives. Ces alliages sont susceptibles de durcissement structural, c’est-à-dire qu’on obtient les caractéristiques mécaniques optimales, principalement sur les formules adaptées au moulage de pièces, à l’aide de traitements thermiques précis de mise en solution et de revenus. Par rapport aux alliages de la famille magnésium-zinc-zirconium, ils apportent les modifications suivantes: caractéristiques mécaniques élevées dans l’intervalle 200-350 0C, même après des traitements de plusieurs milliers d’heures, et notamment résistance au fluage; module d’élasticité maintenu à 250 0C au niveau de 75 p. 100 de la valeur à 20 0C alors que, pour un alliage Mg-Zn-Zr, il est à cette température réduit à 25 p. 100 de sa valeur à 20 0C; aptitude remarquable au moulage.
Le tableau 1 indique, pour cinq alliages filés et cinq alliages moulés les plus typiques, les caractéristiques mécaniques à la traction mesurées à la température ambiante et à 300 0C; il indique aussi la limite de fatigue en flexion alternée à 107 alternances, mesurée à 20 0C. Lorsque la température s’abaisse au-dessous de l’ambiante, les caractéristiques de résistance et le module d’élasticité s’élèvent. L’allongement de rupture et la striction s’abaissent sans toutefois que les alliages puissent être considérés comme fragiles.
Assez récemment, on a réalisé, par frittage et extrusion de poudre partiellement oxydée, une gamme d’alliages du type Mg-MgO dont la résistance à la déformation est d’autant plus marquée si l’on compare aux alliages avec le zirconium et le thorium, que la température est élevée et la durée de service prolongée. Leur domaine d’application est celui des pièces soumises à des contraintes de compression à chaud ou à froid.
Aptitudes à la mise en forme
Le magnésium et la majorité de ses alliages ont un réseau à mailles hexagonales dont le domaine de large déformation plastique se situe à une température supérieure à 200 0C. À la température ambiante, les variations de section sont limitées à 10 p. 100 pour les alliages du type Mg-Al-Zn et 20 p. 100 pour les alliages du type Mg-Zn-Zr.
L’alliage Mg-Li 14 et ses dérivés ont un réseau à mailles cubiques centrées. Ils se laissent bien déformer à température ordinaire par les techniques classiques de laminage, étirage, pliage, etc.
Les alliages de magnésium présentent une très bonne aptitude à la déformation dans le domaine 250-400 0C par forgeage, extrusion à la presse ou laminage. Les limites de la capacité de déformation sont données par la technologie du matériel et des outillages et non par le métal.
Les alliages de magnésium, et particulièrement ceux contenant du zirconium, se prêtent bien au moulage suivant les procédés traditionnels: au sable vert, en coquille, par gravité et sous pression. Les techniques récentes telles que la coulée sous basse pression et à la cire perdue leur sont applicables. Les pièces obtenues peuvent être, à la fois, saines, minces et de grandes dimensions.
3. Propriétés physico-chimiques
Caractéristiques physiques
Le magnésium a pour masse atomique 24,312. Il existe trois isotopes naturels de nombres de masse 24 (77,4 p. 100), 25 (11,5 p. 100) et 26 (11,1 p. 100). Des isotopes artificiels de masses 23, 27 et 28 ont été synthétisés. La structure électronique à l’état fondamental est 1 s 2; 2 s 2, 2 p 6; 3 s 2; le rayon atomique vaut 0,160 nm.
Le tableau 1 (partie droite) présente les caractéristiques physiques principales du magnésium commercial à 99,8 p. 100 et de quelques alliages.
C’est le plus léger des matériaux métalliques produits à échelle industrielle. À volume égal, l’aluminium pèse 1,55 fois plus, le titane 2,55, le fer 4,5 et le cuivre 5. Cette propriété est à la base d’un certain nombre d’applications.
La conductibilité thermique est relativement élevée. Le magnésium vient au quatrième rang des métaux industriels derrière l’argent, le cuivre et l’aluminium et avant le zinc, le nickel, le fer et le titane. Les alliages et notamment ceux au zinc, zirconium et thorium conservent une conductibilité thermique relativement élevée qui favorise les utilisations à chaud.
La section de capture des neutrons thermiques est particulièrement favorable pour le magnésium. Seul le béryllium présente un coefficient plus faible. Le zirconium et l’aluminium sont trois fois plus absorbants, le fer neuf fois plus. Cette propriété a été largement exploitée dans la fabrication des gaines de combustibles de la filière uranium naturel-graphite-dioxyde de carbone.
Caractéristiques chimiques
Dans la classification périodique, le magnésium appartient au groupe II A; il est caractérisé par le seul degré d’oxydation + II; l’ion Mg2+ est incolore et de saveur amère.
Les propriétés chimiques sont dominées par la très grande réactivité du métal qui se rapproche, sur ce point, des métaux alcalino-terreux. La chaleur d’oxydation est très grande, ce qui en fait un réducteur très énergique d’un grand nombre de chlorures métalliques. Cette réaction est utilisée en métallurgie pour la production de métaux tels que le titane, le zirconium, l’uranium... La magnésie (MgO) ne constitue pas, en général, pour le métal, une barrière protectrice efficace vis-à-vis de la progression de l’oxydation. La vitesse d’oxydation à chaud d’un barreau de magnésium dans l’air sec et humide est indiquée au tableau 2. Dans le dioxyde de carbone sec et sous pression, la vitesse d’oxydation du magnésium et de l’alliage magnésium-zirconium est du type parabolique: le gain de poids est de l’ordre de 50 mg/cm2 pendant les mille premières heures et de l’ordre de 100 mg/cm2 pendant les trois mille heures suivantes. Dans certains milieux (fluor sec, gaz sulfureux), il se forme un film protecteur, même au-delà du point de fusion.
Dans l’échelle des potentiels, le magnésium est le moins noble des métaux et alliages industriels (potentiel de dissolution: face=F0019 漣 1,60 V). Il réagit avec la plupart des acides en libérant de l’hydrogène:

Cette propriété s’explique par un caractère fortement électropositif, moins marqué cependant que celui des alcalino-terreux.
Sous forme de poudre, le magnésium brûle avec une lumière intense, riche en ultraviolets; il continue même à brûler dans une atmosphère d’anhydride carbonique. Il donne également des réactions violentes avec les éléments non métalliques pour peu que ceux-ci soient oxydants (halogènes, soufre, azote et phosphore). Les composés formés sont assez nettement ioniques avec les éléments les plus fortement électronégatifs (chlore, fluor...). L’iodure, au contraire, a une structure lamellaire du type de celle de l’iodure de cadmium. L’ion Mg2+ par son rayon de 0,065 nm s’apparente plus aux ions des métaux de transition (Fe2+: 0,076, Co2+: 0,074, Ni2+: 0,072) qu’aux ions alcalino-terreux (entre 0,1 et 0,14 nm).
Composés
La magnésie MgO est une poudre blanche obtenue par calcination de l’hydroxyde2 Mg(OH) ou de la magnésite MgC3. Elle est isotype d’un grand nombre d’oxydes des métaux de transition comme elle de structure NaCl. C’est un excellent produit réfractaire qui sert à faire des creusets de laboratoire et que l’on peut agglomérer sous forme de briquettes pour les revêtements de fours métallurgiques à caractère basique.
Le sulfate existe dans la nature à l’état de monohydrate (kiesérite) et à l’état heptahydraté (sel d’Epsom). Ce dernier est le chef de file de la série dite magnésienne de formule générale [M(H2O)6]S4.H2O, dans laquelle M représente un grand nombre d’éléments divalents de rayon conique inférieur à 0,1 nm, le manganèse, le zinc ou le chrome. Il appartient également à une famille de nombreux sels doubles de formule générale M2M (SO4)2.6H2O dans lequel M est un «métal» monovalent (K, Rb, Cs, NH4) et M un «métal» divalent (Mg, Fe, Co, Ni).
En chimie organique, la réaction de Grignard est très utilisée pour la production des organomagnésiens. De formule générale RMgX dans laquelle R est un radical alcoyle ou aryle et X un halogène (iode, brome ou chlore), ces réactifs sont encore aujourd’hui parmi les plus précieux en synthèse organique.
4. Domaines d’application
Les fonctions réductrices du magnésium donnent lieu à des applications tant en métallurgie (magnésiothermie) qu’en chimie (réaction de Grignard). Le caractère analogique du magnésium en fait un agent énergique, très employé dans la protection des pièces d’acier soumises à une corrosion par voie humide: cuves contenant de l’eau ou des liquides non déshydratés, canalisations enterrées, pieds d’ouvrages d’art métalliques, etc.
Le rapport de la limite élastique à la densité classe les alliages du magnésium parmi les matériaux intéressants pour les industries aéronautique et automobile. Des critères technologiques tels que la possibilité d’obtenir des pièces saines à parois minces, par exemple, jointe à la conductibilité élevée ou à la remarquable capacité d’amortissement des vibrations, peuvent faire choisir les alliages de magnésium de préférence à d’autres matériaux. On utilise, en fait, des carters, des tubes, des profilés de magnésium dans la fabrication des avions, des engins et des projectiles (fig. 1).
Le magnésium est, parmi les métaux industriels, celui qui se prête le mieux à l’usinage mécanique (tabl. 3). Il exige la puissance relative de coupe (P) minimale et permet des vitesses d’avance (V) élevées: aussi, le coût particulièrement économique de l’usinage des alliages de magnésium, joint à leur stabilité dimensionnelle et à leur faible densité, en font des matériaux très remarquables comme barres de décolletage ou support d’assemblage. Cette application est particulièrement développée aux États-Unis.
Dans les centrales nucléaires de production d’énergie, de type uranium naturel-graphite-dioxyde de carbone, la fonction de gainage du «combustible» est assurée par des alliages de magnésium. Elle consiste à former autour du barreau en alliage d’uranium, et malgré les déformations en service de ce dernier, une enveloppe restant étanche pendant dix mille heures environ, placée sous un rayonnement de neutrons, dans un courant de dioxyde de carbone à 500 0C. Les alliages retenus et appliqués depuis trente ans sont: en Grande-Bretagne, Mg + 0,8 Al et 0,005 Be, traité thermiquement, pour sa bonne résistance à l’oxydation à chaud; en France, Mg + 0,5 Zr + 0,015 Mn, pour sa stabilité à haute température.
Le graphique de la figure 2 exprime la production annuelle de lingots de magnésium dans l’ensemble du monde. On voit que le conflit international 1940-1945 a produit un accroissement considérable de la consommation (avions, engins et projectiles incendiaires). La production mondiale a été en 1992 de 303 000 tonnes. La répartition entre les principaux pays producteurs est donnée dans le tableau 4. La répartition entre les principaux pays consommateurs est donnée dans le tableau 5. La majeure partie (56 p. 100) du magnésium produit est utilisée pour la fabrication d’alliages pour des pièces légères moulées (aéronautique, industrie mécanique, électronucléaire); le reste est employé en chimie ou en métallurgie (réduction chimique du tétrachlorure de titane en titane métal, ainsi que raffinage d’autres petits métaux), ou encore en pharmacie (antidépresseurs, par exemple).
magnésium [ maɲezjɔm ] n. m.
• 1780; de magnésie
♦ Élément atomique (Mg; no at. 12; m. at. 24,30), le deuxième des alcalinoterreux, métal blanc argenté, peu ductile, malléable, qui brûle à l'air avec une flamme blanche éblouissante en donnant de la magnésie. Minerais de magnésium. ⇒ dolomite, epsomite, magnésite. Silicates de magnésium. ⇒ amiante, chrysolithe, olivine, talc. Utilisation du magnésium en photographie, en pyrotechnie. Éclair de magnésium d'un flash. « Dans la lueur du magnésium on put voir que la femme était jeune encore » (Duras).
● magnésium nom masculin (de magnésie) Métal blanc, le plus léger des métaux usuels utilisés en construction mécanique. (Élément de symbole Mg.) Numéro atomique : 12 Masse atomique : 24,305 Température de fusion : 648,8 °C Masse volumique : 1,74 g°cm3
magnésium
n. m. élément alcalino-terreux (symbole Mg) de numéro atomique Z = 12.
— Métal (Mg) gris-blanc.
Encycl. Le magnésium, qui brûle à l'air avec une flamme éblouissante, est employé dans les lampes au magnésium pour la photographie. Il entre dans la composition d'alliages ultra-légers utilisés dans la construction aéronautique. Certains de ses sels servent en thérapeutique.
⇒MAGNÉSIUM, subst. masc.
CHIM. Corps simple; métal blanc, brillant, s'oxydant facilement, brûlant avec une flamme très intense, nécessaire à la croissance et au métabolisme de la plupart des organismes vivants, et ayant de très nombreuses utilisations industrielles ou pharmaceutiques sous forme d'alliage ou de composé (symb. Mg). Acétate, carbonate, citrate, phosphate, sulfate de magnésium. Seuls l'aluminium et le magnésium, parmi les métaux courants, peuvent servir à gainer l'uranium naturel, mais leurs températures d'utilisation sont limitées (GOLDSCHMIDT, Avent. atom., 1962, p.208). Le phosphore, le soufre, le magnésium, le calcium sont principalement des éléments structuraux de la cellule (Hist. gén. sc., t.3, vol.2, 1964, p.757):
• 1. On a essayé de maintenir dans les chaussées une fraîcheur permanente en y introduisant pendant l'été des sels déliquescents absorbant l'humidité de l'atmosphère. Les plus communs sont le chlorure de calcium et le chlorure de magnésium. Ces procédés ne se sont pas répandus parce qu'ils sont eux aussi très coûteux malgré le prix peu élevé du chlorure de calcium.
BOURDE, Trav. publ., 1929, p. 149.
— En partic. Poudre ou fil de magnésium servant à produire une lueur vive et fugace pour les prises de vue photographiques ou en pyrotechnie. Appareil au magnésium; fulguration du magnésium. Tout à coup, de puissants jets de magnésium ou de lumière électrique, grossis cent mille fois, partent du sommet de quelque colline fleurie (VILLIERS DE L'I.-A., Contes cruels, 1883, p. 67). Comme c'était sa première arrestation, et que cela attirait sur lui l'attention, il s'est fait photographier au magnésium, pour un journal, tandis qu'il me saisissait au collet (MORAND, New-York, 1930, p.186):
• 2. Quelle belle galerie de monstres nous faisions, dans les éclairs du magnésium, avec nos petites cervelles excitées, chacune sur sa chimère, nos lunettes miroitantes et nos mèches pathétiques.
GUÉHENNO, Journal «Révol.», 1938, p. 165.
♦P. méton. Éclair, lumière produit par le magnésium qui brûle. Dans ce paysage de pierre dont le magnésium fouillait tous les recoins. Je vous garantis qu'ils savaient se planquer! (VERCEL, Cap. Conan, 1934, p. 147).
Prononc. et Orth.:[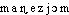 ]. Att. ds Ac. 1878 et 1935. L'accent aigu marque la francisation du mot. Étymol. et Hist. 1818 (TH. THOMSON, Trad. de RIFFAULT DES HÊTRES, Système de chim., t.1, p.400). Dér. savant de magnésie; suff. -ium. Fréq. abs. littér.:33.
]. Att. ds Ac. 1878 et 1935. L'accent aigu marque la francisation du mot. Étymol. et Hist. 1818 (TH. THOMSON, Trad. de RIFFAULT DES HÊTRES, Système de chim., t.1, p.400). Dér. savant de magnésie; suff. -ium. Fréq. abs. littér.:33.
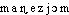 ]. Att. ds Ac. 1878 et 1935. L'accent aigu marque la francisation du mot. Étymol. et Hist. 1818 (TH. THOMSON, Trad. de RIFFAULT DES HÊTRES, Système de chim., t.1, p.400). Dér. savant de magnésie; suff. -ium. Fréq. abs. littér.:33.
]. Att. ds Ac. 1878 et 1935. L'accent aigu marque la francisation du mot. Étymol. et Hist. 1818 (TH. THOMSON, Trad. de RIFFAULT DES HÊTRES, Système de chim., t.1, p.400). Dér. savant de magnésie; suff. -ium. Fréq. abs. littér.:33.
magnésium [maɲezjɔm] n. m.
ÉTYM. 1818; de magnésie.
❖
♦ Élément chimique (Mg) indispensable à la vie, métal léger (dens. 1,74; p. at. 24,31), blanc argenté, ductile et malléable, fusible à 651 °C et qui brûle à l'air avec une flamme blanche éblouissante en donnant de la magnésie. || Préparation du magnésium par électrolyse à partir du chlorure de magnésium. || Silicates de magnésium. ⇒ Amiante, magnésite, stéatite, talc. || Sulfate de magnésium utilisé comme purgatif. ⇒ Sel (anglais, d'Epsom, de Sedlitz). || La kaïnite, sel de magnésium. — Alliages au magnésium. ⇒ Almasilicium, duralumin, partinium. || Emploi du magnésium en photographie et en pyrotechnie. || Ruban, poudre de magnésium. || Éclair de magnésium d'un flash. ⇒ Magnésique. || Bombes incendiaires au magnésium.
1 Nous entendîmes les clairons. C'était la retraite aux flambeaux. Cent torches éclairaient soudain la foule, comme, après la lumière douce des rampes, le magnésium éclate pour photographier une nouvelle étoile.
R. Radiguet, le Diable au corps, p. 22.
2 À ce moment un éclair de magnésium illumina l'espace, faisant apparaître deux personnes toutes deux pourvues d'un appareil photographique.
G. Duhamel, le Voyage de P. Périot, X.
❖
COMP. Ferromagnésien, organo-magnésien.
Encyclopédie Universelle. 2012.