- АЛМАЗ
-
(тюрк. алмас, от греч. adamas — несокрушимый), природный и синтетич. кристалл углерода. В природе встречается в виде отд. монокристаллов или скоплений крист. зёрен и агрегатов. Различают наиб. чистые и совершенные ювелирные А. и техн. А. Точечная группа симметрии m3m, плотн. 3,07—3,56 г/см3. При T>1000°С происходит превращение А. в графит. Атомы С в структуре А. связаны прочной ковалентной связью с четырьмя соседними атомами, расположенными в вершинах тетраэдра (рис.).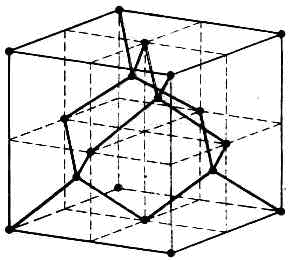 Этим, а также малыми межат. расстояниями (0,154 нм) объясняются св-ва А., в частности его уникальная твёрдость (10 по шкале Мооса) и хим. стойкость (А. растворяется в расплавах калиевой и натриевой селитры и Na2CO3 при T==500°С, на воздухе сгорает при Т =850—1000°С, в кислороде — при T=720—800°С). А. имеет большую теплопроводность (в 5 раз большую, чем у Си); при комнатной темп-ре диамагнитен, магнитная восприимчивость m=0,49•10-6 ед. СГС при 18°С.Цвет и прозрачность А. различны. Большинство кристаллов избирательно поглощают эл.-магн. излучение в ИК области (l=8—10 мкм) и УФ области (l=0,3 мкм).Они наз. А. 1-го типа. А. 2-го типа прозрачны при l=0,22—1000 мкм. Различие спектроскопич. св-в обусловлено, по-видимому, содержанием примесей (гл. обр. N) и тонкими различиями крист. строения. Показатель преломления n= 2,417 для l=0,589 мкм, диэлектрическая проницаемость e=5,7. Нек-рые кристаллы обладают двойным лучепреломлением.Уд. электрич. сопротивление А. 1-го типа r=1012— 1014 Ом•м (диэлектрик). Нек-рые А. 2-го типа имеют r=0,5•10 Ом•м. Они явл. примесными ПП p-типа (встречаются кристаллы А. с r=10-2 Ом•м). А.— ПП, обладают большой шириной запрещённой зоны и уникальной теплопроводностью. У нек-рых неполупроводниковых кристаллов 2-го типа электропроводность резко возрастает при облучении их заряж. ч-ми и g-квантами.Синтетич. А. получают из графита и углеродсодержащих в-в. Получен в сер. 1950-х гг. (США, Швеция, ЮАР), в СССР — в 1960 в нн-те Физики высоких давлений АН СССР. Давление равновесия термодинамического pp между А. и графитом при 0 К равно 108 Па и возрастает с ростом темп-ры Т. При ррр стабилен графит, при р>рр—А. Однако превращение А. в графит при ррр происходит с заметной скоростью только при достаточно высокой темп-ре. Поэтому при атм. давлении и темп-ре до 1000°С А. «живёт» неограниченно долго (мета-стабильное состояние). Минимальные параметры превращения графита в А.: темп-pa t=1100°С и давление р=4ГПа (см. ДАВЛЕНИЕ ВЫСОКОЕ). Для облегчения синтеза используются различные агенты (Fe, Ni и их сплавы), способствующие разрушению или деформации кристаллической решётки графита или снижающие энергию, необходимую для её перестройки. После создания необходимого давления смесь нагревают до темп-ры синтеза, а затем охлаждают до комнатной темп-ры и снимают давление. В эксперим. физике А. применяется для резки и полировки кристаллов, измерения изменений темп-ры, как детекторы яд. излучений (кристаллический счётчик) и др.
Этим, а также малыми межат. расстояниями (0,154 нм) объясняются св-ва А., в частности его уникальная твёрдость (10 по шкале Мооса) и хим. стойкость (А. растворяется в расплавах калиевой и натриевой селитры и Na2CO3 при T==500°С, на воздухе сгорает при Т =850—1000°С, в кислороде — при T=720—800°С). А. имеет большую теплопроводность (в 5 раз большую, чем у Си); при комнатной темп-ре диамагнитен, магнитная восприимчивость m=0,49•10-6 ед. СГС при 18°С.Цвет и прозрачность А. различны. Большинство кристаллов избирательно поглощают эл.-магн. излучение в ИК области (l=8—10 мкм) и УФ области (l=0,3 мкм).Они наз. А. 1-го типа. А. 2-го типа прозрачны при l=0,22—1000 мкм. Различие спектроскопич. св-в обусловлено, по-видимому, содержанием примесей (гл. обр. N) и тонкими различиями крист. строения. Показатель преломления n= 2,417 для l=0,589 мкм, диэлектрическая проницаемость e=5,7. Нек-рые кристаллы обладают двойным лучепреломлением.Уд. электрич. сопротивление А. 1-го типа r=1012— 1014 Ом•м (диэлектрик). Нек-рые А. 2-го типа имеют r=0,5•10 Ом•м. Они явл. примесными ПП p-типа (встречаются кристаллы А. с r=10-2 Ом•м). А.— ПП, обладают большой шириной запрещённой зоны и уникальной теплопроводностью. У нек-рых неполупроводниковых кристаллов 2-го типа электропроводность резко возрастает при облучении их заряж. ч-ми и g-квантами.Синтетич. А. получают из графита и углеродсодержащих в-в. Получен в сер. 1950-х гг. (США, Швеция, ЮАР), в СССР — в 1960 в нн-те Физики высоких давлений АН СССР. Давление равновесия термодинамического pp между А. и графитом при 0 К равно 108 Па и возрастает с ростом темп-ры Т. При ррр стабилен графит, при р>рр—А. Однако превращение А. в графит при ррр происходит с заметной скоростью только при достаточно высокой темп-ре. Поэтому при атм. давлении и темп-ре до 1000°С А. «живёт» неограниченно долго (мета-стабильное состояние). Минимальные параметры превращения графита в А.: темп-pa t=1100°С и давление р=4ГПа (см. ДАВЛЕНИЕ ВЫСОКОЕ). Для облегчения синтеза используются различные агенты (Fe, Ni и их сплавы), способствующие разрушению или деформации кристаллической решётки графита или снижающие энергию, необходимую для её перестройки. После создания необходимого давления смесь нагревают до темп-ры синтеза, а затем охлаждают до комнатной темп-ры и снимают давление. В эксперим. физике А. применяется для резки и полировки кристаллов, измерения изменений темп-ры, как детекторы яд. излучений (кристаллический счётчик) и др.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- АЛМАЗ
-
(тюрк. алмас, от греч. adamas - несокрушимый) - аллотропная модификация углерода, кристаллич. решётка к-рой относится к кубич. сингонии (см. ниже). А. стабилен при высоких давлениях и метастабилен при нормальных условиях, хотя и может при них существовать неопределённо долго. При нагревании он переходит в графит (темп-pa перехода составляет для синтетич. микропорошков 450-500°С, для кристаллов размерами от 0,6 до 1 мм - 600-700°С и зависит от совершенства структуры, кол-ва и характера примесей). Принято считать, что кристаллы природного А. сгорают в воздухе при темп-ре св. 850°С, в потоке О 2 - св. 750°С.
Атомы углерода в структуре А. образуют четыре кова-лентные связи с валентным углом 109°28' (направление связей совпадает с осями L3 тетраэдра). Ср. значение пост. решётки
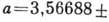
 (при темп-ре 25°С и давлении 1 атм) и возрастает при нагревании. Элементарная ячейка А. образована атомами, расположенными по вершинам куба, в центре его граней (рис. 1, атомы 1, 5, 7) и в центрах четырёх несмежных октантов куба (атомы 6, 4, 2, 8). Каждый атом С находится в центре тетраэдра, вершинами к-рого служит четыре ближайших атома. В природе А. встречается в виде отд. кристаллов, сростков, агрегатов (бесцветных или окрашенных), а также поликристаллич. образований (баллас, карбонадо). Физ. и механич. свойства, окраска, скульптура поверхности обусловлены прежде всего дефектами кристаллич. решётки,
(при темп-ре 25°С и давлении 1 атм) и возрастает при нагревании. Элементарная ячейка А. образована атомами, расположенными по вершинам куба, в центре его граней (рис. 1, атомы 1, 5, 7) и в центрах четырёх несмежных октантов куба (атомы 6, 4, 2, 8). Каждый атом С находится в центре тетраэдра, вершинами к-рого служит четыре ближайших атома. В природе А. встречается в виде отд. кристаллов, сростков, агрегатов (бесцветных или окрашенных), а также поликристаллич. образований (баллас, карбонадо). Физ. и механич. свойства, окраска, скульптура поверхности обусловлены прежде всего дефектами кристаллич. решётки,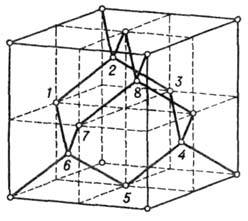
Рис. 1.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.