ALCANES
Les alcanes sont des hydrocarbures (formés uniquement de carbone et d’hydrogène) de formule générale Cn H2n +2. Ils appartiennent à la série aliphatique , c’est-à-dire que leur squelette carboné ne comporte pas d’enchaînement cyclique. Ils sont saturés , car leur structure ne présente que des liaisons simples.
Ils existent en abondance à l’état naturel dans les matières organiques fossiles: le gaz naturel et les pétroles.
Leur réactivité chimique est essentiellement de nature radicalaire, à l’exception de l’action des réactifs très fortement électrophiles. Cette faible réactivité globale les a fait désigner autrefois sous le nom de paraffines (parum affinis : de faible affinité).
Formule générale et isomérie
L’ensemble des atomes de carbone de la molécule d’alcane forme une chaîne où chaque carbone est tétracoordiné soit à quatre atomes d’hydrogène, c’est le cas du méthane CH4, soit à un carbone et trois hydrogènes comme dans les groupes méthyle situés aux extrémités de la chaîne (carbones primaires 漣CH3), soit à deux carbones et deux hydrogènes (carbones secondaires >CH2), soit à trois carbones et un hydrogène (carbones tertiaires 漣>CH), soit à quatre carbones dans l’intérieur de la chaîne (carbones quaternaires >C<). Quand la chaîne ne comporte que des atomes secondaires avec, à chaque extrémité, un atome primaire, c’est un alcane linéaire ou normal . La chaîne carbonée peut en outre comporter des atomes tertiaires ou quaternaires avec un atome primaire à l’extrémité de chacune des chaînes linéaires partielles, c’est alors un alcane ramifié présentant des nœuds iso ou néo . Les alcanes en C1, C2, C3 sont uniques mais, dès que la condensation en carbone est supérieure à 3, plusieurs formules développées correspondent à la même formule brute et il existe alors des alcanes isomères. C’est ainsi qu’à la formule C4H10 correspondent le butane normal à chaîne linéaire et l’isobutane à chaîne ramifiée comportant trois carbones primaires et un carbone tertiaire (isomères de structure). À la formule C5H12 correspondent trois isomères: le pentane normal, l’isopentane et le néopentane (tabl. 1). À partir de C7 apparaissent, outre les isomères de structure, des stéréo-isomères liés à l’existence d’un atome de carbone asymétrique, ce qui porte de sept à neuf le nombre des isomères. Le tableau 2 indique le nombre N d’alcanes isomères en fonction du nombre n d’atomes de carbone de la chaîne. Le nombre très élevé d’isomères dès que n dépasse 6 impose une nomenclature systématique définissant de manière univoque chacun des alcanes.
Nomenclature
La nomenclature des alcanes est fondamentale, car elle sert de base à celle de l’ensemble des molécules aliphatiques.
Le nom des alcanes est formé d’une racine , tirée du grec, qui indique le nombre des atomes de carbone de la chaîne pour les alcanes normaux ou celui de la chaîne linéaire la plus longue pour les alcanes ramifiés, et d’un suffixe ane qui indique que la molécule est saturée. Le nom formé par la même racine et par le suffixe -yle désigne un radical alkyle dérivé de l’alcane par enlèvement d’un atome d’hydrogène.
Les quatre premiers termes des alcanes linéaires portent des noms triviaux: méthane, éthane, propane, n -butane. Les suivants sont dénommés systématiquement: C5, pentane; C6, hexane; C7, heptane; C10, décane; C11, undécane; C12, dodécane; C20, éicosane; C21, hénéicosane; C22, docosane; C23, tricosane; C30, tricontane; C31, hentricontane; C100, hectane (tabl. 3).
Pour former le nom des alcanes ramifiés , on prend comme squelette de base l’enchaînement linéaire le plus long qui donnera le nom de la molécule, les autres chaînes constituant des ramifications alkyle. Chacune de ces dernières est ensuite considérée selon le même principe: on prend comme chaîne alkyle l’enchaînement linéaire le plus long et on traite comme des substituants alkyle les chaînes plus courtes fixées sur elle. On numérote la chaîne principale de telle sorte que les chaînes latérales aient le plus petit indice possible et on dénomme l’alcane en commençant par la désignation des chaînes latérales alkyle dans un ordre alphabétique (les préfixes en italique tertio [t -], secondaire [sec -] n’interviennent pas dans ce classement), suivie du numéro des atomes de la chaîne principale auxquels elles sont fixées. Le numérotage de cette dernière est choisi de telle sorte que la somme des nombres caractéristiques des chaînes latérales soit minimale. En anglais, le numéro précède le nom de la chaîne alkyle (tabl. 4).
État naturel et préparations
Le constituant principal du gaz naturel est le méthane, mais il est accompagné d’éthane, de propane et de butanes.
Les pétroles sont des mélanges d’un grand nombre d’hydrocarbures, où les alcanes, notamment linéaires, prédominent, et de molécules fonctionnelles en petit nombre. Soumis aux opérations de raffinage [cf. PÉTROLE], ils sont séparés par distillation fractionnée en coupes contenant des mélanges dont les températures d’ébullition sont comprises dans un intervalle défini. Les termes les plus légers sont gazeux à température et pression ordinaires (C1-C4), ils sont le plus généralement utilisés comme gaz combustibles (usages domestique et industriel) et comme matières premières pour la pétroléochimie. Les coupes C5-C6 (ébullition 20-60 0C), éther de pétrole, et C6-C7 (ébullition 60-100 0C), naphta léger ou white-spirit, sont essentiellement utilisées comme solvants. La coupe C6-C11 (ébullition 60-200 0C) constitue l’essence, base de la fabrication des carburants, et également, pour la partie appelée naphta (C6-C10), la matière première soumise au vapocraquage pour la pétroléochimie. La fraction C11-C16 (ébullition 180-280 0C), appelée kérosène, est principalement utilisée comme carburant dans les turboréacteurs et les moteurs Diesel et comme combustible (fioul léger) pour le chauffage domestique. La fraction supérieure à C18 (ébullition 礪 350 0C) constitue le résidu atmosphérique et est utilisée comme combustible (fioul lourd) pour le chauffage industriel (centrales thermiques). Soumise à une distillation sous pression réduite, elle fournit des huiles lubrifiantes légères (C18-C25, ébullition 300-400 0C) et lourdes (C26-C36, ébullition 400-500 0C). Les résidus de cette distillation sous vide sont des asphaltes. Le craquage thermique, en présence ou non de catalyseurs et d’hydrogène, de certaines de ces coupes permet d’en modifier la constitution et de les adapter aux divers usages indiqués. Le craquage thermique en présence de vapeur d’eau de la coupe naphta, suivi d’une séparation par distillation fractionnée, fournit à l’industrie chimique les molécules de base carbonées en C2-C4 (éthylène, propène, butènes, butadiène) dont elle a besoin (pétroléochimie).
La préparation, en laboratoire, des alcanes est assez rare.
Elle peut s’effectuer par réduction de molécules fonctionnelles:
– hydrogénation catalytique sur platine, en phase gazeuse ou en phase liquide, des halogénures d’alkyle:

– hydrolyse des organomagnésiens:

– hydrogénation des cétones et aldéhydes par le zinc amalgamé et l’acide chlorhydrique concentré (réaction de Clemmensen) ou par action de la potasse sur l’hydrazone résultant de l’action de l’hydrazine sur la fonction carbonyle (réaction de Wolff-Kishner):
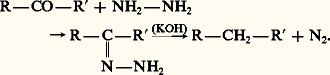
Elle peut également se faire par voie synthétique:
– méthode historique de Wurtz (chauffage en tube scellé d’un iodure d’alkyle et de sodium):
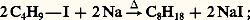
cette méthode a permis la synthèse, à l’état pur, d’alcanes en C40, C50, C70;
– synthèse de Corey-House (les cuprates de dialkyllithium réagissent avec les halogénures d’alkyle en formant des alcanes); cette méthode permet d’obtenir des hydrocarbures linéaires à nombre impair d’atomes de carbone:
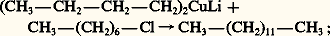
– action, sur un organomagnésien, d’un bromure d’alkyle tertiaire:

– électrolyse d’une solution aqueuse d’un carboxylate alcalin (la décarboxylation, à l’anode, de l’anion carboxylate libère un radical libre alkyle qui se dimérise en alcane):

Propriétés physiques
Gazeux jusqu’en C4, les alcanes sont liquides de C5 à C16, puis solides à la température ordinaire.
Une propriété remarquable des alcanes linéaires est la variation de leur température de fusion en fonction de la condensation en carbone de la chaîne: pour les premiers termes et jusqu’en C18 les alcanes à nombre pair d’atomes de carbone fondent quelques dizaines de degrés plus haut que leur homologue immédiatement inférieur à nombre impair de C (fig. 1). L’explication de cette absence de monotonie des points de fusion de ces alcanes se trouve dans la conformation des chaînes carbonées qui, étant en zigzag, s’arrangent mieux dans le réseau cristallin (donc fondent plus haut) lorsque les groupes méthyle terminaux (n pair) sont en opposition, par suite d’une augmentation des forces intermoléculaires d’association. Les températures d’ébullition, par contre, qui ne sont pas soumises, dans l’état liquide et l’état gazeux, aux mêmes interactions spécifiques suivent une évolution monotone en fonction de la condensation en carbone. Les isomères ramifiés bouillent plus bas que les linéaires.
Insolubles dans l’eau, les alcanes sont eux-mêmes de bons solvants lipophiles. Le white-spirit utilisé dans le dégraissage est un mélange complexe renfermant essentiellement des alcanes en C6-C7.
Structure des alcanes
La chaîne carbonée des alcanes étant formée d’atomes de carbone tétracoordinés (hybridation sp3), l’angle que font entre elles les liaisons 靖 qui en sont issues est voisin de 1100. Les interactions (répulsives) entre atomes non liés portés par deux carbones voisins varient avec leurs positions relatives, c’est-à-dire avec la conformation de la chaîne. L’énergie interne de la molécule d’alcane varie donc avec sa conformation, le minimum d’énergie correspondant à la situation dans laquelle les liaisons issues de deux carbones voisins sont décalées anti et le maximum à la conformation éclipsée [fig. 2] (cf. CONFORMATIONS - Chimie). Cette variation d’énergie avec la rotation des groupes autour des liaisons C 漣C entraîne donc une gène (stérique) à cette rotation: l’augmentation d’énergie correspondant au passage d’un couple d’atomes de la conformation décalée anti à la conformation éclipsée est de l’ordre de 13 kJ/mole, c’est-à-dire que, à température ordinaire, les alcanes liquides ou gazeux présentent une population conformationnelle très diverse dans laquelle prédominent les conformères décalés anti . À l’état solide, par contre, les chaînes ont tendance à adopter une conformation toute décalée anti , c’est-à-dire une structure plane en zigzag (fig. 3).
Propriétés chimiques
Les électronégativités du carbone sp3 et de l’hydrogène étant très voisines, la molécule d’alcane est pratiquement apolaire et, de ce fait, elle n’a pas d’affinité pour les réactifs ioniques (électrophiles, nucléophiles). Les principales réactions sont de nature radicalaire: substitution, élimination et fragmentation radicalaires.
Réactions de coupure des liaisons C size=4漣C et C size=4漣H
Thermodynamiquement les alcanes, à l’exception du méthane, sont instables par rapport à leurs éléments, c’est-à-dire que, à la température ordinaire, leur réaction de décomposition en carbone et hydrogène est exothermique. Toutefois, la vitesse de cette réaction ne devient appréciable qu’à une température relativement élevée: 650 0C pour l’éthane, 500 0C pour le propane et qui tend vers une limite de 400 0C pour les termes de condensation en carbone plus élevée.
Craquage et isomérisation
Portés pendant un temps très court (de 0,5 à 2 s) à une température élevée (700-850 0C), les alcanes en C5-C9, qui sont les principaux constituants des coupes de distillation des pétroles appelées naphtas, subissent une série de réactions de fragmentation homolytique et de recombinaison qui les transforment en un mélange de molécules à chaîne plus courte, saturées (alcanes) et insaturées (alcènes, alcadiènes). C’est la réaction de craquage thermique, généralement pratiquée en présence de vapeur d’eau afin de diminuer la pression partielle des hydrocarbures (vapocraquage). Sous l’action de la température se produit la coupure homolytique de liaisons C 漣C qui conduit à des radicaux libres dont la réaction avec d’autres molécules et d’autres radicaux est responsable de la formation des molécules plus courtes, saturées ou non (réactions 1).
La rupture des liaisons C 漣C se produit préférentiellement à celle des liaisons C 漣H par suite de l’importante différence d’énergie de dissociation de ces liaisons (345 kJ/mole et 413 kJ/mole). Réalisée sur d’importants tonnages d’hydrocarbures, l’opération de vapocraquage du naphta transforme en France, annuellement, quelque 8 millions de tonnes de pétrole en éthylène (2 Mt), propylène (1,2 Mt) et autres hydrocarbures courts en C4, matières premières essentielles de la chimie de base (cf. PÉTROLE - Pétrochimie).
En présence de catalyseurs acides, les alcanes en C4 et plus subissent une isomérisation réversible. À la température ordinaire, l’équilibre s’établit lentement et le rendement en isomères ramifiés est maximal. À température plus élevée, la vitesse d’isomérisation augmente mais le pourcentage en isomères ramifiés diminue. Cette réaction est pratiquée industriellement pour transformer les alcanes normaux en C4, C5, C6 en isomères ramifiés, qui apportent aux essences un indice d’octane élevé, le butane normal en isobutane en vue de la synthèse (procédé Oxirane) de l’oxyde de propylène et du tertiobutanol.
Alkylation
L’alkylation , par les alcanes ramifiés, des alcènes ramifiés est une réaction d’importance industrielle pour la production de carburants à haut indice d’octane. C’est l’une des rares réactions non radicalaires des alcanes, qui se produit en catalyse fortement acide (acide sulfurique, acide fluorhydrique anhydre) [réactions 2]. L’isobutène (I) est transformé par l’acide fluorhydrique en fluorure du cation triméthylcarbénium (II). Ce dernier arrache un ion hydrure à l’alcane ramifié (III), le transformant lui-même en cation carbénium (IV) qui attaque une seconde molécule d’isobutène (I) en formant un nouvel ion carbénium (V). Celui-ci, jouant le même rôle que le cation triméthylcarbénium (II), donne l’alcane ramifié de condensation (VI) en régénérant le carbénium (IV): c’est une réaction en chaîne ionique .
Déshydrogénation
La coupure de liaisons C 漣H, avec départ d’hydrogène, est thermodynamiquement possible à température élevée (600 0C) car, dans ces conditions, les alcènes obtenus sont plus stables que les alcanes correspondants. Des catalyseurs sélectifs à base d’alumine et d’oxyde de chrome favorisent cette réaction aux dépens de la fragmentation thermique. La réaction est équilibrée et on déplace généralement l’équilibre en opérant sous faible pression. C’est ainsi que l’on produit le butadiène à partir du butane, avec passage intermédiaire aux butènes que l’on n’isole pas (réaction 3). On régénère périodiquement le catalyseur, pollué par les dépôts de carbone dus à la fragmentation parasite, par une oxydation à l’oxygène.
Oxydation et combustion
Stables vis-à-vis de l’oxygène à température ordinaire, les alcanes subissent, à partir de 150 0C, des réactions d’oxydation qui conduisent à des mélanges très complexes de produits oxydés dans lesquels prédomine l’acide acétique dont c’est un des procédés de fabrication (cf. acide ACÉTIQUE). La réaction est radicalaire en chaîne et fait intervenir la formation d’hydroperoxydes ROOH dont les réactions, notamment de rupture, engendrent une très grande variété de composés oxygénés (acides, aldéhydes, cétones, alcools, esters); on peut la catalyser par des sels de cobalt. Réalisée en présence d’acide borique (BO2H), l’oxydation des alcanes normaux en C10-C20 s’arrête esentiellement au stade d’alcools secondaires sans coupure de chaîne: il se forme initialement des hydroperoxydes d’alkyle avec lesquels l’acide borique réagit pour former directement des esters boriques, stables vis-à-vis de l’oxydation et de la température.
La combustion des alcanes à l’air est une réaction fortement exothermique (réaction 4) qui est abondamment exploitée pour la production de chaleur (chauffage industriel et domestique) et d’énergie mécanique (moteurs à combustion interne, réacteurs). La chaleur de combustion des alcanes à n atomes de carbone est approximativement de 658 n + 243 kJ/mole; les premiers termes étant relativement plus riches en hydrogène, leur chaleur de combustion est un peu plus élevée. Le pouvoir calorifique, quantité de chaleur dégagée par la combustion de 1 kg d’alcane, tend vers une limite de 46 000 kJ/kg quand n augmente indéfiniment. Cette limite a imposé l’emploi de carburants spéciaux, plus énergétiques, dans les fusées. La combustion incomplète de méthane conduit au noir de carbone (carbon black ) utilisé comme pigment dans les encres, peintures, vernis et comme charge renforçatrice pour améliorer les propriétés mécaniques des caoutchoucs.
Réactions de substitution
Les réactions de substitution des alcanes sont à peu près exclusivement radicalaires. L’alcane est attaqué par un radical libre qui arrache un atome d’hydrogène. Il se transforme lui-même en radical libre qui est d’autant plus stable que le carbone porteur de l’électron célibataire est plus substitué:

Ce radical libre attaque le réactif électrophile en donnant le produit de substitution et en formant un nouveau radical libre (réaction en chaîne). La chloration et la bromation thermique ou photochimique des alcanes conduit à des dérivés mono- ou polyhalogénés. La réaction 5 est celle du butane.
Le fluor réagit violemment avec les alcanes en libérant du carbone et du fluorure d’hydrogène HF. L’iode ne réagit pas et, à chaud par contre, l’iodure d’hydrogène réduit les iodures d’alkyle en alcane et iode (Berthelot). La monochloration des alcanes linéaires en C10-C13 est réalisée industriellement par action du chlore sur les hydrocarbures en phase liquide à 120 0C (initiation thermique). Les chloroalcanes obtenus (mélanges) sont portés à 300 0C sur catalyseur de silicate d’alumine où ils subissent une déshydrochloration en donnant des oléfines linéaires dont c’est un procédé de préparation.
La chlorosulfonation des alcanes est une réaction industrielle qui est réalisée par action, sur l’hydrocarbure, de dioxyde de soufre et de chlore sous l’action de la lumière à 20-25 0C. Les chlorures d’alkylsulfonyle obtenus donnent par hydrolyse alcaline les alkylsulfonates alcalins (réaction 6). Lorsque l’alcane de départ est linéaire et possède une chaîne de 12 à 18 atomes de carbone, le mélange d’alkylsulfonates obtenu présente des propriétés amphiphiles résultant de l’existence, dans leur molécule, d’une longue chaîne hydrocarbonée lipophile et d’un groupe fonctionnel hydrophile. Ces produits sont des tensio-actifs utilisés comme détergents.
La nitration des alcanes par l’acide nitrique se produit en phase vapeur à des températures de l’ordre de 450 0C. La réaction est à la fois un craquage thermique de l’alcane et une réaction radicalaire en chaîne avec l’acide nitrique: on obtient un mélange de nitro-alcanes (réaction 7). Les nitro-alcanes sont utilisés comme solvants et comme intermédiaires dans la synthèse de nitro-alcools et d’amino-alcools.
Complexes d’insertion
L’urée et la thiourée ont la propriété de former avec les alcanes linéaires de plus de 6 atomes de carbone des composés d’addition cristallisés et stables appelés complexes d’insertion ou clathrates. Il suffit de mélanger des solutions méthanoliques ou acétiques des deux composés pour que le clathrate précipite à l’état cristallin. Les molécules d’urée sont organisées autour de la longue chaîne hydrocarbonée en hélice formant un tunnel cylindrique. Les alcanes ramifiés ne peuvent pénétrer à l’intérieur du cylindre.
Cette propriété particulière a été mise à profit dans un procédé de séparation des alcanes linéaires de C15 à C30 d’un mélange où ils sont accompagnés d’isomères ramifiés. Les alcanes linéaires sont libérés par dissolution dans l’eau du clathrate.
Encyclopédie Universelle. 2012.