VALENCE
À toute représentation de la matière qui la suppose grenue, se rattachent deux genres d’intuitions, l’une privilégiant les formes, l’autre les forces. On peut, en effet, imaginer sous le mode de l’intensité les interactions entre les particules ultimes de la chimie, et sous le mode de la distribution leur occupation de l’espace. La théorie moderne de la liaison chimique subordonne ces deux aspects dans un même corps spéculatif; mais ils donnèrent lieu, auparavant, à des élaborations théoriques distinctes. L’idée de valence fut l’une de celles-ci. Formée dans la seconde moitié du XIXe siècle, elle constitue aujourd’hui un ingrédient fondamental de la pédagogie de la chimie, au même titre que les concepts d’élément et de masse atomique. Cependant, si nécessaire qu’il puisse paraître au premier abord dans l’appareillage théorique de la chimie, ce concept est désormais plus initiateur qu’initial; au fil des rectifications et des ajustements successifs, il a perdu de sa force hégémonique première, au point que Georges Champetier pouvait, il y a plusieurs décennies, juger la valence «une notion assez artificielle dont la nécessité ne se fait plus absolument sentir».
Les valences sont des indices numériques attachés aux différents éléments, qui rendent compte des régularités observées dans leur groupement en molécules.
L’analyse des combinaisons définies permet de les représenter par des formules telles que Am Bn dans lesquelles A et B figurent les masses atomiques des éléments A et B, m et n étant des entiers. Pour une combinaison réunissant trois espèces atomiques différentes, on a une formule ternaire du type Am Bn Cp , etc. Dans la collection des éléments, certains forment des composés binaires dont les formules sont soit du type AB, soit du type ABn , sans que l’on puisse jamais en rencontrer du type Am B; c’est, par exemple, le cas du fluor qui est souvent pris pour référence de la capacité de combinaison, en raison de la multitude de ses composés; l’indice n des composés binaires du fluor BFn est la valence (par rapport à cet élément) des corps simples entrant en combinaison avec lui. De proche en proche, en composant les formules de combinaisons, on constitue un système de valences dans lequel chaque élément se trouve crédité d’indices échelonnés de 1 à 7.
La polyatomicité
On assigne généralement à Edward Frankland le mérite d’avoir, le premier, explicité la notion de valence. Dans un article de 1852, où il rend compte de la préparation de composés organométalliques du zinc, de l’étain et du mercure, il en compare la constitution à celle des dérivés cacodyliques et stilbéniques, et induit de la symétrie des formules que «le pouvoir de combinaison de l’élément attractif [...] est toujours satisfait par le même nombre des atomes qui s’agrègent, indépendamment de leur caractère propre». En 1861, revenant sur la nature des composés organométalliques, il en infère une «doctrine de la saturation atomique» qui a pour proposition fondamentale que «chaque élément est capable de se combiner avec un certain nombre d’atomes» et que «ce nombre ne peut jamais être surpassé».
Mais, dans les vues de Frankland, un même élément peut exhiber plusieurs atomicités lorqu’il se combine avec une même espèce atomique (et, a fortiori, avec divers atomes ou radicaux). Examinant, dans un Discourse de 1861, la série des combinaisons d’éléments polyatomiques, tels que l’azote, le phosphore ou l’arsenic, il discerne justement divers états de stabilité des composés, observant que «dans les corps possédant au moins un état de stabilité au-dessous de la saturation, et dans lesquels tous les atomes unis à l’élément polyatomique sont de même espèce, le stade du maximum de stabilité est très rarement celui de la saturation». Ce faisant, il liait la doctrine en voie de constitution de la valence aux aspects énergétiques attachés de longue date à l’imagination des affinités. En 1866, il distinguera expressément les atomicités «latentes» et «actives» diversement composées dans le bilan de l’atomicité «absolue» qui correspond à notre notion empirique de valence maximale de chaque élément.
C’est à August Wilhelm Hofmann qu’il appartient, en 1865, dans son Introduction to Modern Chemistry, Experimental and Theoretic , de bien marquer le départ entre l’affinité des liaisons interatomiques et la valence des éléments expressément définie sous le vocable quantivalence : «ce mot est employé pour désigner la puissance numérique de balance atomique dans chacun des éléments, et cette puissance ne doit, en aucune façon, être confondue avec l’intensité spécifique de leurs activités chimiques respectives».
La thèse de la polyatomicité ne fut pas reçue unanimement; l’opposition la plus notable se manifesta en la personne prestigieuse de Friedrich August Kekule, qui affirma, en outre, avoir été l’authentique inventeur de la notion de valence; la postérité lui déniera cette prétention, tout en admirant en lui l’initiateur de la chimie structurale. L’idée de la concaténation du carbone dans les composés organiques, réglée par la prescription de sa quadrivalence, fut clairement formulée, en 1858, dans un article des Liebigs Annalen . On a déjà indiqué la fécondité de cette conception dans l’article KEKULE VON STRADONITZ. En revanche, on n’a pas évoqué le conflit de théorie qui aboutira à récuser l’invariabilité de valence, obstinément soutenue par le grand chimiste allemand.
Dès 1864, soucieux de réfuter les arguments des tenants de la polyatomicité, il propose une distinction entre combinaisons atomiques et moléculaires: «Les combinaisons dans lesquelles tous les éléments sont tenus ensemble par les affinités des atomes qui se saturent mutuellement pourraient être nommées combinaisons atomiques.» Ce sont les seules qui puissent exister à «l’état de vapeur »; à quoi il oppose les circonstances où «l’attraction des atomes dans des molécules différentes provoque le rapprochement et la juxtaposition des molécules [...]; il peut arriver que la réaction s’arrête à ce rapprochement, que les deux molécules se collent ensemble, formant ainsi un groupe doué d’une certaine stabilité.» Cette conception permettrait de conserver la valence 2 du sélénium et du tellure, 3 de l’azote et du phosphore, etc. Cependant, de nombreux composés complexes sujets à la décomposition thermique furent enrôlés dans ce groupe des «composés moléculaires», qui toutefois ne tarda pas à être jugé arbitraire et artificiel par quantité de chimistes.
Une autre manœuvre tentée par les partisans de Kekule pour sauver la conception de l’invariabilité consista à supposer des formules de constitution en chaînes; ainsi l’on maintenait la monovalence du chlore dans la série de ses combinaisons oxygénées, au lieu de les lier aux valences 2, 3, 5 et 7.
On proposa par un autre artifice, des formules dimères. En écrivant le chlorure ferreux Fe2Cl4, on conservait au fer la valence 3. Mais les procédés cryoscopiques et ébullioscopiques de détermination des poids moléculaires, mis en honneur par François Raoult, invalidèrent cette supposition: la molécule est, en effet, monomère; sa composition répond à FeCl2, ce qui assigne au fer la valence 2 dans les combinaisons ferreuses, la valence 3 étant réservée aux composés ferriques.
Valence et coordinence
Alors que la thèse de la polyatomicité était universellement reconnue, après la mort de Kekule, et figurait comme argument fondamental dans les systèmes chimiques de la fin du XIXe siècle, les conceptions d’Alfred Werner allaient bouleverser l’ordre des constats précédemment élaborés. Dans ses Neuere Anschauungen de 1905, Werner observe que «les faits de la chimie inorganique nous convainquent constamment qu’aucune représentation adéquate de la structure des composés inorganiques ne peut être dérivée de la théorie de valence développée à partir de la constitution des corps organiques». S’attachant à l’étude de ce que l’on appellera des «complexes de coordination», Werner découvre un type d’affinité chimique dont ne rendait pas compte la théorie élémentaire de la valence. Ses conceptions supposaient, au demeurant, deux corps de théorie préalables: la conception stéréochimique de la valence entendue comme propriété directionnelle et la dissociation ionique mise en évidence par Arrhenius, qui implique l’idée d’électrovalence.
Dès 1893, à la suite de ses investigations sur les amines du chlorure de cobalt, Werner est conduit à distinguer la valence et le nombre de coordination. La valence est, pour lui, le «nombre maximum d’atomes univalents qui, en l’absence d’autres atomes, se combinent directement avec un atome donné». Quant au nombre de coordination, c’est dans ses vues «le nombre maximum d’atomes ou de groupes d’atomes susceptibles de se combiner directement avec un atome donné». En construisant des modèles de «composés moléculaires», stables et dissymétriques, autour d’un atome central de métal, Werner instituait l’important chapitre de la chimie des complexes tout en dirigeant l’attention des chimistes sur l’opportunité d’un travail théorique sur la nature de la liaison chimique, dont les modalités apparaissaient de plus en plus complexes.
Caractère virtuel de la valence
La mise en évidence de l’électron et la construction des modèles planétaires de l’atome par Joseph John Thomson, Ernest Rutherford et Niels Bohr conduisirent les théoriciens à considérer la valence comme l’expression chimique de propriétés électriques des atomes. Walther Kossel pouvait ainsi, en 1915, énoncer que «chaque élément successif [de la classification périodique] renferme un électron et une charge positive de plus que son prédécesseur. Le fait que la valence change périodiquement prouve qu’en passant des éléments légers aux éléments lourds la configuration [électronique] ne varie pas uniformément. Tandis que des configurations sont régulièrement atteintes dans lesquelles est répété le nombre des électrons motivant la valence, les configurations associées avec l’inertie chimique apparaissent de même régulièrement: ce sont celles des gaz rares. Nous concevons la propriété de valence comme attachée essentiellement au comportement des électrons périphériques des atomes».
Peu auparavant, Gilbert Newton Lewis avait proposé sa conception du mode de liaison homopolaire ou covalence, imputée à des doublets électroniques; ceux-ci résultent de la participation mutuelle de chaque atome lié, en sorte qu’à chaque doublet corresponde une unité de valence.
Vue comme objet électronique, la molécule sera bientôt analysée à l’aide des concepts de la mécanique ondulatoire. Leur application, traitée dans l’article LIAISONS CHIMIQUES, met en évidence le caractère unitaire de la liaison chimique qui résulte «toujours de la mise en commun d’électrons par paires de spins antiparallèles sur des niveaux moléculaires».
Constitué initialement dans le champ théorique d’une combinatoire des affinités chimiques, le système des valences fonctionne comme l’index de capacités de saturations respectives. Les distinctions que les chimistes furent amenés à faire entre les modes empiriques d’association de divers types de substances contribuèrent cependant à brouiller les relations trop simples supposées d’abord entre valence et structure. La tétravalence du carbone, présentée initialement comme une espèce de dogme que validait, en apparence, la fécondité des applications, dut ainsi, peu à peu, entrer en composition avec l’évidence du carbone bivalent, et même du carbone trivalent, tel qu’il apparaît dans le triphénylméthyle et d’autres «radicaux libres». Les représentations des états de résonance et de la mésomérie instituèrent le caractère virtuel de la valence qui sera réduite peu à peu à la fonction d’une règle de composition dans un champ technique délimité. Il s’agit donc d’un concept dont l’hégémonie théorique fut toute transitoire; il conserve assurément sa valeur dans la pratique. On lui doit, cependant, de grands bénéfices de théorie. Il a supporté, en effet, la classification fondamentale de Mendeleïev et servi de règle aux efforts de la chimie quantique dont les formalismes ont pris le système des valences comme critère de validité.
valence [ valɑ̃s ] n. f.
• 1871; bas lat. valentia, d'apr. équivalence
1 ♦ Chim. Nombre de liaisons chimiques qu'un atome ou un ion engage avec d'autres atomes ou ions dans une combinaison. Électrons de valence : électrons d'un atome, responsables des liaisons de cet atome avec d'autres atomes.
♢ Phys. Bande de valence : dans le spectre d'un cristal à l'état solide, Domaine dans lequel se placent les énergies des électrons de valence qui permettent la cohésion du cristal.
2 ♦ Psychol. Puissance d'attraction (valence positive) ou de répulsion (valence négative), d'un objet ou d'une activité.
3 ♦ (1975) Valence écologique (d'une espèce animale ou végétale),sa tolérance envers les différents facteurs du milieu.
● valence nom féminin (anglais valency, du bas latin valentia, capacité, avec l'influence de équivalence) Nombre possible des atomes d'une nature donnée qui peuvent se lier chimiquement à un atome déterminé. ● valence (expressions) nom féminin (anglais valency, du bas latin valentia, capacité, avec l'influence de équivalence) Bande de valence, bande de plus haute énergie des niveaux électroniques d'un solide isolant ou semi-conducteur, qui, à température suffisamment basse, est complètement occupée par des électrons. Électrons de valence, électrons d'un atome responsables des liaisons de cet atome avec d'autres atomes. ● valence ou valencia nom féminin (de Valence, ville d'Espagne) Orange de maturité tardive, qui occupe une grande place dans le commerce international.
valence
(en esp. Valencia) v. et port d'Espagne, sur la Méditerranée; cap. de la communauté autonome du m. nom, réunissant les prov. d'Alicante, Castellón et Valence (23 305 km²; 3 902 400 hab.); 758 700 hab.
— Archevêché. Université. Cath. (XVIe s., remaniée au XVIIIe s.). égl. baroques. Lonja de la Seda (halle de la soie, XVe s.). Portes fortifiées.
— La ville, fondée par les Grecs, passa aux Carthaginois, puis aux Romains. Prise par les Wisigoths (413), puis par les Arabes (714), elle fut conquise par le Cid (1094), tomba aux mains des Almoravides (1102) et passa à l'Aragon en 1238. Elle fut un centre de résistance aux Français (1808-1812). Le gouv. républicain y siégea deux fois pendant la guerre civile (1936-1939).
————————
valence
n. f.
d1./d CHIM Nombre de liaisons chimiques engagées par un atome dans une combinaison chimique.
d2./d ZOOL Valence écologique: possibilité pour une espèce vivante d'habiter des milieux variés.
d3./d PSYCHO Valence d'un objet: attirance (valence positive) ou répulsion (valence négative) qu'un sujet éprouve à son égard.
————————
valence
n. f. Variété d'orange d'Espagne.
I.
⇒VALENCE1, subst. fém.
Vieilli. Orange provenant de la région de Valence. Des marchandes d'oranges poussaient leurs charrettes, braillant à tue-gorge: la belle valence! La belle valence! (HUYSMANS, Sœurs Vatard, 1879, p. 92). 100 gr d'oranges pelées, soit à peu près la valeur d'une belle « Valence », renferment moins d'éléments glycogéniques que 10 grammes de pain (LE GENDRE ds Nouv. Traité Méd. fasc. 7 1924, p. 472).
Prononc. et Orth.:[ ]. Homon. et homogr. valence2. Étymol. et Hist. 1839 (Dict. du Commerce et des Marchandises, contenant tout ce qui concerne le commerce de terre et de mer, t. 2, p. 1674, s.v. oranges). Du nom de Valence (esp. Valencia), située dans la riche huerta du même nom où l'on cultive en partic. des agrumes, important centre d'exportation.
]. Homon. et homogr. valence2. Étymol. et Hist. 1839 (Dict. du Commerce et des Marchandises, contenant tout ce qui concerne le commerce de terre et de mer, t. 2, p. 1674, s.v. oranges). Du nom de Valence (esp. Valencia), située dans la riche huerta du même nom où l'on cultive en partic. des agrumes, important centre d'exportation.
 ]. Homon. et homogr. valence2. Étymol. et Hist. 1839 (Dict. du Commerce et des Marchandises, contenant tout ce qui concerne le commerce de terre et de mer, t. 2, p. 1674, s.v. oranges). Du nom de Valence (esp. Valencia), située dans la riche huerta du même nom où l'on cultive en partic. des agrumes, important centre d'exportation.
]. Homon. et homogr. valence2. Étymol. et Hist. 1839 (Dict. du Commerce et des Marchandises, contenant tout ce qui concerne le commerce de terre et de mer, t. 2, p. 1674, s.v. oranges). Du nom de Valence (esp. Valencia), située dans la riche huerta du même nom où l'on cultive en partic. des agrumes, important centre d'exportation.II.
⇒VALENCE2, subst. fém.
A. — CHIM., PHYS.
1. ,,Propriété de substitution, de saturation ou de combinaison que possède tout élément chimique`` (CHARLES 1960).
2. En partic.
a) Valeur numérique exprimant ,,le nombre d'atomes d'hydrogène avec lesquels un élément ou un radical peut se combiner (valence négative) ou le nombre d'atomes d'hydrogène qu'un élément ou un radical peut déplacer (valence positive)`` (Eau 1981). Par définition, l'hydrogène a une valence positive égale à 1 (MUSSET-LLORET 1964). Suivant la valeur de ce nombre, le corps est dit zérovalent, mono- ou univalent, bi- ou divalent. On ne connaît pas de valence supérieure à 8 (QUILLET 1965).
♦ Valence d'un atome. ,,Nombre de paires d'électrons qu'un atome peut avoir en commun avec d'autres atomes`` (Méd. Flamm. 1975). H. Bateman, définit la valence d'un atome par le nombre de degrés de liberté qu'il possède dans certaines réactions (Radium, 1909, p. 152).
♦ Valence d'un ion. ,,Nombre de charges électriques positives ou négatives portées par l'ion`` (Méd. Flamm. 1975). Synon. électrovalence (s.v. électri-).
♦ Liaisons de valence. Liaisons représentées symboliquement par des tirets, chaque tiret représentant deux électrons. La logique conduit à douter de la valeur de ces formules où les liaisons de valence sont, d'ailleurs, distribuées avec le seul souci de les satisfaire (CAILLÈRE, HÉNIN, Minér. argiles, 1963, p. 23).
b)  ) Électron de valence. Électron périphérique d'un atome, responsable des liaisons de cet atome avec d'autres atomes. L'effet Zeeman anormal est un phénomène d'apparence très compliquée. Nous nous bornerons à le décrire dans le cas le plus simple, celui des atomes alcalins pour lesquels on peut considérer le spectre visible comme émis par l'électron le plus extérieur, l'électron de valence (L. DE BROGLIE, Théorie quanta, 1959, p. 243).
) Électron de valence. Électron périphérique d'un atome, responsable des liaisons de cet atome avec d'autres atomes. L'effet Zeeman anormal est un phénomène d'apparence très compliquée. Nous nous bornerons à le décrire dans le cas le plus simple, celui des atomes alcalins pour lesquels on peut considérer le spectre visible comme émis par l'électron le plus extérieur, l'électron de valence (L. DE BROGLIE, Théorie quanta, 1959, p. 243).
 ) Électron de valence. Électron périphérique d'un atome, responsable des liaisons de cet atome avec d'autres atomes. L'effet Zeeman anormal est un phénomène d'apparence très compliquée. Nous nous bornerons à le décrire dans le cas le plus simple, celui des atomes alcalins pour lesquels on peut considérer le spectre visible comme émis par l'électron le plus extérieur, l'électron de valence (L. DE BROGLIE, Théorie quanta, 1959, p. 243).
) Électron de valence. Électron périphérique d'un atome, responsable des liaisons de cet atome avec d'autres atomes. L'effet Zeeman anormal est un phénomène d'apparence très compliquée. Nous nous bornerons à le décrire dans le cas le plus simple, celui des atomes alcalins pour lesquels on peut considérer le spectre visible comme émis par l'électron le plus extérieur, l'électron de valence (L. DE BROGLIE, Théorie quanta, 1959, p. 243). ) Bande de valence. Bande de faible énergie pour laquelle les électrons d'un métal ne participent pas à la conductibilité électrique. Lorsqu'on élève la température, l'agitation thermique du réseau peut faire passer un électron de la bande de valence dans la bande immédiatement supérieure, appelée « bande de conduction » (Hist. gén. sc., t. 3, vol. 2, 1964, p. 304).
) Bande de valence. Bande de faible énergie pour laquelle les électrons d'un métal ne participent pas à la conductibilité électrique. Lorsqu'on élève la température, l'agitation thermique du réseau peut faire passer un électron de la bande de valence dans la bande immédiatement supérieure, appelée « bande de conduction » (Hist. gén. sc., t. 3, vol. 2, 1964, p. 304).B. — P. anal.
1. ÉCOL. Valence écologique. Possibilité pour une espèce animale ou végétale de coloniser des milieux différents. La valence écologique d'un organisme peut varier au cours de son développement (Lar. encyclop. Suppl. 1975).
2. IMMUNOL. Valence d'un antigène. ,,Nombre de molécules d'anticorps avec lesquelles la molécule d'antigène est susceptible de se combiner`` (Méd. Flamm. 1975).
3. INFORM., TÉLÉCOMM. Valence d'un code. ,,Nombre d'éléments distincts par leur nature employés dans un code pour constituer les combinaisons de code ou les groupes d'éléments de signal`` (GDEL).
4. LINGUISTIQUE
a) [Chez Tesnière] Nombre d'actants qu'un verbe est susceptible de régir. Valence verbale. Les verbes intransitifs ont nécessairement la valence 1 (MOUNIN 1974).
b) Valence lexicale. ,,Indice de sélection égal au pouvoir d'un mot à se substituer à d'autres en contexte`` (MOUNIN 1974)
5. PSYCHOL. Puissance d'attraction (valence positive) ou de répulsion (valence négative) qu'un individu éprouve à l'égard d'un objet ou d'une situation. Valence et valeur de satisfaction sont étroitement liées. Un aliment aura une valence positive pour une personne qui a faim (SILL. 1965).
REM. 1. Valence-gramme. V. rem. 1 b  s.v. gramme. 2. Valentiel, -elle, adj., chim. ,,Qui concerne la valence; en particulier s'applique à la liaison par électrons des couches externes`` (DUVAL 1959). Électrons valentiels (Lexis 1975).
s.v. gramme. 2. Valentiel, -elle, adj., chim. ,,Qui concerne la valence; en particulier s'applique à la liaison par électrons des couches externes`` (DUVAL 1959). Électrons valentiels (Lexis 1975).
 s.v. gramme. 2. Valentiel, -elle, adj., chim. ,,Qui concerne la valence; en particulier s'applique à la liaison par électrons des couches externes`` (DUVAL 1959). Électrons valentiels (Lexis 1975).
s.v. gramme. 2. Valentiel, -elle, adj., chim. ,,Qui concerne la valence; en particulier s'applique à la liaison par électrons des couches externes`` (DUVAL 1959). Électrons valentiels (Lexis 1975).Prononc. et Orth.:[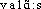 ]. Homon. et homogr. valence1. Étymol. et Hist. 1. 1879 chim. (A. WURTZ, La Théorie atomique, Paris ds Bibl. sc. internat., t. 27, p. 56 et p. 155); 2. p. anal. a) 1921 « possibilité de communication, possibilité de liaison » (WARCOLLIER, La Télépathie, p. 43 t p. 272); b) 1926 psychol. valence affective (R. LAFORGUE, Schizophrénie et schizonoïa in R. fr. de psychanal., 1re année, n° 1, p. 7 ds QUEM. DDL t. 29); c) 1936 biol. valence des gènes (CUÉNOT, J. ROSTAND, Introd. génét., p. 42); d) 1953 ling. (L. TESNIÈRE, Esquisse d'une synt. struct., p. 5); e) 1969 écol. (PLAIS.); 1975 électron. et informat. (LE GARFF); 3. 1927 p. ext. « faculté à exprimer une valeur ou notion particulière » (DAM.-PICH. t. 1 1968 [1911-27],100); 1932 (OVIO, Vision coul., p. 281: valences optiques [= valeurs élémentaires de stimulation]). Empl. comme subst. autonome de l'élém. -valence de termes de chim. comme monovalence (1868, v. monovalent étymol.) où la forme -valence trad. l'all. -valenz (cf. en 1865 quantivalenz, en 1868 subst. Valenz d'apr. NED Suppl.2, s.v. valence) ou -valentigkeit (1864, WURTZ d'apr. COTTEZ 1982). L'angl. avait trad. le lat. valentia « force, vigueur, courage, faculté » par les 2 formes valence et valency et les a employées d'apr. l'all. en chim. (1868 valence, 1869 valency ds NED Suppl.2, v. aussi NED), d'où l'empl. p. anal. de valence en psychol. (1917 ds NED Suppl.2). Bbg. BLANCHE-BENVENISTE (Cl.). La Complémentation verbale: valence, rection et associés. Rech. sur le fr. parlé: 3. Aix-en-Provence; Paris, 1981, pp. 57-98. — HAPP (H.). Théor. de la valence et enseign. du fr. Fr. mod. 1978, t. 46, pp. 97-134. — KOCH (P.). Verb, Valenz, Verfügung... Heidelberg, 1981, 400 p. — KOTSCHI (Th.). Verbvalenz im Frz. Beiträge zur Linguistik des Frz. Tübingen, 1981, pp. 80-122.
]. Homon. et homogr. valence1. Étymol. et Hist. 1. 1879 chim. (A. WURTZ, La Théorie atomique, Paris ds Bibl. sc. internat., t. 27, p. 56 et p. 155); 2. p. anal. a) 1921 « possibilité de communication, possibilité de liaison » (WARCOLLIER, La Télépathie, p. 43 t p. 272); b) 1926 psychol. valence affective (R. LAFORGUE, Schizophrénie et schizonoïa in R. fr. de psychanal., 1re année, n° 1, p. 7 ds QUEM. DDL t. 29); c) 1936 biol. valence des gènes (CUÉNOT, J. ROSTAND, Introd. génét., p. 42); d) 1953 ling. (L. TESNIÈRE, Esquisse d'une synt. struct., p. 5); e) 1969 écol. (PLAIS.); 1975 électron. et informat. (LE GARFF); 3. 1927 p. ext. « faculté à exprimer une valeur ou notion particulière » (DAM.-PICH. t. 1 1968 [1911-27],100); 1932 (OVIO, Vision coul., p. 281: valences optiques [= valeurs élémentaires de stimulation]). Empl. comme subst. autonome de l'élém. -valence de termes de chim. comme monovalence (1868, v. monovalent étymol.) où la forme -valence trad. l'all. -valenz (cf. en 1865 quantivalenz, en 1868 subst. Valenz d'apr. NED Suppl.2, s.v. valence) ou -valentigkeit (1864, WURTZ d'apr. COTTEZ 1982). L'angl. avait trad. le lat. valentia « force, vigueur, courage, faculté » par les 2 formes valence et valency et les a employées d'apr. l'all. en chim. (1868 valence, 1869 valency ds NED Suppl.2, v. aussi NED), d'où l'empl. p. anal. de valence en psychol. (1917 ds NED Suppl.2). Bbg. BLANCHE-BENVENISTE (Cl.). La Complémentation verbale: valence, rection et associés. Rech. sur le fr. parlé: 3. Aix-en-Provence; Paris, 1981, pp. 57-98. — HAPP (H.). Théor. de la valence et enseign. du fr. Fr. mod. 1978, t. 46, pp. 97-134. — KOCH (P.). Verb, Valenz, Verfügung... Heidelberg, 1981, 400 p. — KOTSCHI (Th.). Verbvalenz im Frz. Beiträge zur Linguistik des Frz. Tübingen, 1981, pp. 80-122.
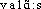 ]. Homon. et homogr. valence1. Étymol. et Hist. 1. 1879 chim. (A. WURTZ, La Théorie atomique, Paris ds Bibl. sc. internat., t. 27, p. 56 et p. 155); 2. p. anal. a) 1921 « possibilité de communication, possibilité de liaison » (WARCOLLIER, La Télépathie, p. 43 t p. 272); b) 1926 psychol. valence affective (R. LAFORGUE, Schizophrénie et schizonoïa in R. fr. de psychanal., 1re année, n° 1, p. 7 ds QUEM. DDL t. 29); c) 1936 biol. valence des gènes (CUÉNOT, J. ROSTAND, Introd. génét., p. 42); d) 1953 ling. (L. TESNIÈRE, Esquisse d'une synt. struct., p. 5); e) 1969 écol. (PLAIS.); 1975 électron. et informat. (LE GARFF); 3. 1927 p. ext. « faculté à exprimer une valeur ou notion particulière » (DAM.-PICH. t. 1 1968 [1911-27],100); 1932 (OVIO, Vision coul., p. 281: valences optiques [= valeurs élémentaires de stimulation]). Empl. comme subst. autonome de l'élém. -valence de termes de chim. comme monovalence (1868, v. monovalent étymol.) où la forme -valence trad. l'all. -valenz (cf. en 1865 quantivalenz, en 1868 subst. Valenz d'apr. NED Suppl.2, s.v. valence) ou -valentigkeit (1864, WURTZ d'apr. COTTEZ 1982). L'angl. avait trad. le lat. valentia « force, vigueur, courage, faculté » par les 2 formes valence et valency et les a employées d'apr. l'all. en chim. (1868 valence, 1869 valency ds NED Suppl.2, v. aussi NED), d'où l'empl. p. anal. de valence en psychol. (1917 ds NED Suppl.2). Bbg. BLANCHE-BENVENISTE (Cl.). La Complémentation verbale: valence, rection et associés. Rech. sur le fr. parlé: 3. Aix-en-Provence; Paris, 1981, pp. 57-98. — HAPP (H.). Théor. de la valence et enseign. du fr. Fr. mod. 1978, t. 46, pp. 97-134. — KOCH (P.). Verb, Valenz, Verfügung... Heidelberg, 1981, 400 p. — KOTSCHI (Th.). Verbvalenz im Frz. Beiträge zur Linguistik des Frz. Tübingen, 1981, pp. 80-122.
]. Homon. et homogr. valence1. Étymol. et Hist. 1. 1879 chim. (A. WURTZ, La Théorie atomique, Paris ds Bibl. sc. internat., t. 27, p. 56 et p. 155); 2. p. anal. a) 1921 « possibilité de communication, possibilité de liaison » (WARCOLLIER, La Télépathie, p. 43 t p. 272); b) 1926 psychol. valence affective (R. LAFORGUE, Schizophrénie et schizonoïa in R. fr. de psychanal., 1re année, n° 1, p. 7 ds QUEM. DDL t. 29); c) 1936 biol. valence des gènes (CUÉNOT, J. ROSTAND, Introd. génét., p. 42); d) 1953 ling. (L. TESNIÈRE, Esquisse d'une synt. struct., p. 5); e) 1969 écol. (PLAIS.); 1975 électron. et informat. (LE GARFF); 3. 1927 p. ext. « faculté à exprimer une valeur ou notion particulière » (DAM.-PICH. t. 1 1968 [1911-27],100); 1932 (OVIO, Vision coul., p. 281: valences optiques [= valeurs élémentaires de stimulation]). Empl. comme subst. autonome de l'élém. -valence de termes de chim. comme monovalence (1868, v. monovalent étymol.) où la forme -valence trad. l'all. -valenz (cf. en 1865 quantivalenz, en 1868 subst. Valenz d'apr. NED Suppl.2, s.v. valence) ou -valentigkeit (1864, WURTZ d'apr. COTTEZ 1982). L'angl. avait trad. le lat. valentia « force, vigueur, courage, faculté » par les 2 formes valence et valency et les a employées d'apr. l'all. en chim. (1868 valence, 1869 valency ds NED Suppl.2, v. aussi NED), d'où l'empl. p. anal. de valence en psychol. (1917 ds NED Suppl.2). Bbg. BLANCHE-BENVENISTE (Cl.). La Complémentation verbale: valence, rection et associés. Rech. sur le fr. parlé: 3. Aix-en-Provence; Paris, 1981, pp. 57-98. — HAPP (H.). Théor. de la valence et enseign. du fr. Fr. mod. 1978, t. 46, pp. 97-134. — KOCH (P.). Verb, Valenz, Verfügung... Heidelberg, 1981, 400 p. — KOTSCHI (Th.). Verbvalenz im Frz. Beiträge zur Linguistik des Frz. Tübingen, 1981, pp. 80-122.
1. valence [valɑ̃s] n. f.
ÉTYM. 1839; de la ville de Valence (Valencia), en Espagne.
❖
♦ Orange provenant de la région de Valence, en Espagne.
————————
2. valence [valɑ̃s] n. f.
ÉTYM. 1890, P. Larousse, Deuxième Suppl.; all. valenz (1868), de quantivalenz (1865, Hofmann); cf. bas lat. valentia « valeur », de valere (→ Valoir).
❖
1 Chim. Nombre de liaisons chimiques qu'un atome ou un ion engage avec d'autres atomes ou ions dans une combinaison. || Théorie électronique de la valence, fondée sur la stabilité de la couche la plus externe d'électrons (électrons dits de valence) dont certains se distribuent par transfert ou mise en commun. || Électrovalence, ou valence électrostatique. || Covalence ou valence homopolaire, homéopolaire. ⇒ Covalence. || Plurivalence, ou polyvalence, correspondant à des liaisons multiples (bivalence, trivalence…). ⇒ -valent. || Valence de coordination, les électrons mis en commun provenant du même atome. || Liaisons de valence, représentées symboliquement par des tirets, chaque tiret représentant deux électrons. || Bande de valence : dans le spectre d'un cristal à l'état solide, domaine dans lequel se placent les énergies des électrons de valence qui permettent la cohésion du cristal; la bande de conduction et la bande de valence d'un isolant, d'un semi-conducteur, sont séparées par un intervalle vide; la première se trouve dans un état énergétique supérieur (ce schéma explique actuellement les propriétés de conductibilité, de semi-conductibilité et d'isolement électrique). || Champ de force de valence : hypothèse simplificatrice selon laquelle une constante de force se trouve associée avec chaque liaison de valence et chaque angle de valence (au lieu de supposer un champ quelconque, pour les forces qui ramènent chaque atome à sa position d'équilibre, lorsqu'on veut exprimer l'énergie potentielle de vibration).
➪ tableau Vocabulaire de la chimie.
2 (1926, Laforgue, valence affective, in D. D. L.). Psychol. Puissance d'attraction (valence positive) ou de répulsion (valence négative) d'un objet ou d'une activité.
3 (1975). || Valence écologique (d'une espèce animale ou végétale) : tolérance (de cette espèce) envers les différents facteurs du milieu.
❖
COMP. Électrovalence. Valence-gramme. V. Covalence.
Encyclopédie Universelle. 2012.