REIN
Les fonctions d’excrétion et la régulation de la composition du «milieu intérieur», où vivent les cellules qui composent l’organisme, sont étroitement liées dans toute la série animale; toutefois, ce n’est que chez les Vers qu’apparaissent des organes excréteurs spécialisés: ce sont des tubes (protonéphridies des Turbellariés par exemple, néphridies des Annélides) reliant les espaces interstitiels ou le cœlome au milieu extérieur.
Les reins représentent, dans l’évolution de l’appareil excréteur, un perfectionnement étroitement lié à l’acquisition d’un appareil circulatoire clos (cf. appareil CIRCULATOIRE). Ils sont constitués par de très nombreuses unités fonctionnelles, les néphrons , formés chacun d’un long tube, dont l’extrémité se différencie chez les Vertébrés (sauf certains Poissons) en un organe de filtration, le glomérule. Dès lors, le rein devient un organe excréteur raffiné qui, par le jeu subtil de l’élimination ou de la conservation des composants du sang, assure non seulement l’évacuation des déchets du métabolisme azoté, mais aussi le contrôle de la pression osmotique, de la composition électrolytique du milieu intérieur et même (grâce aux informations fournies par voie endocrine) du volume du sang et des divers compartiments hydriques de l’organisme (cf. métabolisme HYDROMINÉRAL). Le rein assure aussi le maintien de la constance du pH du milieu intérieur (cf. équilibre ACIDO-BASIQUE). Le rein devient donc l’organe essentiel de régulation et de contrôle de la composition de l’organisme.
La néphrologie est la science qui étudie le rein normal et le rein malade. Elle constitue une discipline de pointe, dont les acquisitions ont été bénéfiques pour la médecine tout entière. Parce que le rein malade n’est plus capable d’assurer la constance du milieu intérieur, les néphrologues ont été amenés à créer des dispositifs de contrôle et de correction thérapeutique immédiate, qui ne sont autres que les dispositifs de la «réanimation médicale». Parce que les connaissances physiologiques sur le rein étaient plus avancées qu’aucun autre chapitre de la physiologie, les néphrologues ont pu créer le premier «organe artificiel»: des hommes sans rein peuvent vivre aujourd’hui grâce au rein artificiel. Enfin, parce que les néphrologues étaient naturellement poussés, par la nature de maintes maladies rénales, à se mêler d’immunologie, ils ont eu l’audace de tenter et de réussir la transplantation du rein, ouvrant ainsi un autre grand chapitre de la médecine moderne, celui des greffes d’organes.
1. Structure et fonctions du rein humain
Structure
Le rein des Mammifères est composé de deux zones distinctes: l’une superficielle, ou corticale; l’autre profonde, ou médullaire, qui fait saillie dans les voies excrétrices par plusieurs papilles (fig. 1). L’épaisseur relative de la corticale et de la médullaire varie avec les espèces: la médullaire est particulièrement développée chez les animaux à habitat désertique, qui ont la propriété d’émettre des urines très concentrées, ce qui suggère que les structures contenues dans cette partie des reins jouent un rôle important dans le mécanisme de concentration des urines. On en verra la confirmation plus loin.
Les néphrons
Chaque rein est composé d’environ un million d’unités fonctionnelles, ou néphrons. Chaque néphron comprend deux parties: un glomérule, auquel fait suite un tubule (fig. 2).
Le glomérule est composé d’un floculus, peloton de capillaires enroulés autour d’une tige, ou axe mésangial, et de la capsule de Bowman, qui enveloppe le floculus. Le sang arrive aux capillaires du glomérule à son pôle vasculaire. L’urine primitive sourd, au pôle urinaire, dans l’espace de Bowman débouchant dans le tubule.
Le tubule , ou tube urinifère, est constitué de trois segments: tube proximal , segment grêle de l’anse de Henle et tube distal .
Le tube proximal commence par une partie contournée, située entièrement dans la corticale du rein.
Les cellules qui, à cet endroit, forment la paroi du tube ont une «bordure en brosse» du côté de la lumière du tube; la structure de ces cellules suggère qu’elles sont douées d’une activité intense.
Le segment grêle, ou branche descendante de l’anse de Henle, fait suite au tube proximal et tend à plonger dans la médullaire. Il se recourbe ensuite en épingle à cheveux pour regagner la surface du rein.
Le tube distal commence par un segment rectiligne, ou branche ascendante large de l’anse de Henle. Il se continue par une partie contournée qui reprend curieusement contact avec le pôle vasculaire du glomérule qui est à l’origine de ce même néphron. Un «appareil juxtaglomérulaire» joint, à cet endroit, le tube distal au glomérule. Les tubes distaux débouchent ensuite dans des canaux collecteurs qui se dirigent, par un trajet rectiligne, vers la médullaire; les canaux collecteurs confluent en canaux de Bellini, qui s’ouvrent enfin à la pointe de la papille vers les voies excrétrices de l’urine.
Les néphrons ont, chez l’homme, une longueur totale de 20 à 45 mm; le diamètre des glomérules est de l’ordre de 100 猪m; celui des tubes contournés proximaux ou distaux de 50 à 60 猪m, et celui des segments étroits des anses de Henle de 20 猪m seulement.
La longueur de l’anse de Henle permet de distinguer deux types de néphrons: les néphrons à anse courte, issus de glomérules corticaux, dont l’anse de Henle ne dépasse pas, en profondeur, la médullaire externe; les néphrons à anse longue, issus de glomérules plus profonds, juxta-médulaires, avec une anse de Henle plongeant jusqu’à la région papillaire de la médullaire interne.
L’irrigation sanguine du rein
Le réseau des artères du rein répond à la disposition des néphrons par une organisation singulière qui comporte successivement, à partir des branches de division de l’artère rénale, les artères interlobaires, les artères arquées, les artères interlobulaires, enfin les artérioles afférentes des glomérules (fig. 3). L’importance de l’irrigation sanguine est grande dans le fonctionnement du rein.
Le débit sanguin de cet organe est d’ailleurs très élevé, puisque, pour un poids total de 300 g, les reins reçoivent environ 1,2 l de sang par minute, soit près du quart du débit cardiaque. Le flux sanguin rénal (Fsr ) est ainsi, chez l’homme, huit fois plus élevé que le flux irriguant les muscles squelettiques au repos.
Le Fsr est soumis à une autorégulation précise: dans les limites de pression de perfusion normales, c’est-à-dire avec des variations de pression artérielle allant de 80 à 200 mm de mercure, le débit sanguin rénal reste constant grâce à un ajustement permanent des résistances intrarénales. Ainsi, l’augmentation de la pression de perfusion des reins entraîne une vasoconstriction qui accroît les résistances intrarénales; de même, le rein peut répondre à une diminution modérée de sa pression de perfusion par une vasodilatation qui, en réduisant les résistances intrarénales, évite la diminution du débit sanguin. Cependant, dans les conditions pathologiques marquées par une réduction importante de la pression de perfusion (hémorragie, choc septique), l’action du système nerveux autonome et des catécholamines libérées par la médullo-surrénale conduit à une vasoconstriction intense qui réduit brutalement la vascularisation du rein en la dérivant au profit d’organes vitaux (cœur, cerveau).
La distribution intrarénale du sang peut être étudiée aujourd’hui par des procédés radiographiques (artériographie rénale) et par une série de techniques quantitatives telles que l’enregistrement direct de la courbe de passage d’un indicateur coloré (Kramer, 1960) ou l’analyse de la courbe de disparition d’indicateurs diffusibles radioactifs: krypton 85 (Thorburn, 1963) ou xénon 133 (Hollenberg, 1968).
Dans cette dernière méthode, le gaz radioactif est capté par diffusion dans le tissu rénal en un seul passage: la courbe de décroissance du taux sanguin de ce gaz, mesurée par enregistrement externe de la radioactivité, permet de distinguer trois compartiments principaux dans la cinétique de distribution du sang: le flux cortical, de loin le plus élevé (5 millilitres par minute et par gramme); le flux médullaire externe (1 ml/mn/g); enfin, le flux médullaire interne (0,2 ml/mn/g). L’autorégulation du flux sanguin intrarénal porte surtout sur la fraction corticale. Dans des circonstances pathologiques (hémorragie, choc septique) entraînant une chute brutale du flux total, celle-ci prédomine sur la corticale, alors que le flux sanguin médullaire est relativement préservé.
Mécanismes de la formation de l’urine
La formation de l’urine se fait en deux étapes: une filtration glomérulaire, suivie d’une retouche tubulaire, laquelle comporte la réabsorption ou la sécrétion de certaines substances.
Filtration glomérulaire
La filtration glomérulaire est le premier temps: 20 p. 100 environ du plasma parvenant aux glomérules sont ultrafiltrés à travers la paroi des capillaires glomérulaires et forment l’urine primitive qui s’écoule par l’espace de Bowman; les globules du sang et les protéines, de poids moléculaire supérieur à 60 000, sont retenus dans le sang, alors que les substances diffusibles se retrouvent dans l’ultrafiltrat à la même concentration que dans le plasma.
L’ultrafiltration obéit à des lois physiques simples : la pression de filtration (Pf ) est égale à la pression hydrostatique régnant dans les capillaires glomérulaires (Pg ), diminuée de la pression colloïde osmotique des molécules protéiques (Pc ) et de la pression hydrostatique régnant dans l’espace de Bowman (Ph ), selon la formule classique: Pf = Pg 漣 (Pc + Ph ). Les ordres de grandeur de Pg , de Pc et de Ph seraient, respectivement, de 90, de 30 et de 15 mm Hg, si bien que la valeur normale de Pf serait voisine de 45 mm Hg. Une diminution, voire un arrêt, de la filtration glomérulaire peut survenir à la suite soit d’une diminution de Pg (chute de la pression artérielle au-dessous des valeurs compensées par l’autorégulation du flux sanguin rénal), soit d’une augmentation de Ph (obstacle des voies excrétrices).
La nature intime du processus de filtration glomérulaire reste l’objet de discussions car il n’est pas exclu que le phénomène soit plus complexe qu’il n’y paraît au premier abord et, notamment, que des phénomènes de diffusion (indépendants de la pression de chaque côté de la paroi capillaire) jouent aussi un rôle important.
L’ultrafiltration glomérulaire arrête presque totalement les protéines du sang. L’urine primitive n’en renferme que de petites quantités qui sont réabsorbées dans leur quasi-totalité par le tube proximal, si bien que les urines normales éliminent moins de 0,05 g de protéines par 24 heures, c’est-à-dire des traces négligeables.
Remaniement tubulaire
Le filtrat glomérulaire, ou urine primitive, est profondément remanié dans le tubule rénal. Ce remaniement comporte l’addition de certaines substances prélevées dans le sang par les tubes et sécrétées dans l’urine, et la soustraction de certaines substances qui sont réabsorbées par les cellules du tube, de l’urine vers le sang. Ces mouvements transtubulaires de sécrétion ou de réabsorption sont les uns actifs, les autres passifs.
Les mouvements passifs se font par diffusion simple: aucune dépense d’énergie n’y est nécessaire, sinon celle qui a servi à l’établissement du gradient lui-même. Ainsi, l’urée est, en grande partie, passivement réabsorbée. Les mouvements actifs exigent une dépense d’énergie que l’on peut mesurer par la consommation rénale d’oxygène. Dans les conditions basales, la consommation d’oxygène par les reins représente environ 8 p. 100 de la dépense totale de l’organisme. La majeure partie de cette dépense correspond à la réabsorption active du sodium.
Certaines substances, tels le glucose, les phosphates, sont réabsorbées dans les limites d’un débit maximal de réabsorption tubulaire ou Tm : le Tm du glucose est ainsi de 375 mg/mn, en moyenne, chez l’homme adulte normal.
La réabsorption des acides aminés par le tube proximal est pratiquement totale, comme Bergeron et Morel (1969) l’ont prouvé par des micro-injections d’acides aminés marqués par les isotopes. Certaines anomalies tubulaires congénitales sont caractérisées par la faillite de cette fonction et le passage anormal de certains acides aminés dans l’urine (cystinurie, etc.). Inversement, d’autres substances sont sécrétées activement par les tubes, avec un Tm d’excrétion tubulaire: le Tm de l’acide para-amino-hippurique, ou PAH, par exemple, est de 80 mg/mn chez l’homme adulte. La mesure du Tm de réabsorption ou de sécrétion de ces substances donne une indication sur la masse néphronique active des reins.
Trois modifications essentielles de l’urine primitive, au cours de sa traversée tubulaire, méritent une étude plus approfondie: la réabsorption de l’eau, la réabsorption du sodium, l’excrétion des ions H+.
Réabsorption de l’eau. Concentration et dilution des urines
L’ultrafiltrat glomérulaire, isotonique au plasma, délivre aux tubules une quantité voisine de 120 ml/mn, soit 180 l/j; or, le volume de l’urine finale est, dans les conditions normales, de l’ordre de 1 à 2 l/j; une fraction importante de l’eau filtrée est donc nécessairement réabsorbée. Cette réabsorption est modulée de manière à maintenir constante la quantité d’eau de l’organisme. C’est ainsi que, si l’eau ingérée est restreinte, le rein émet un petit volume d’urines très concentrées, hypertoniques; en surcharge aqueuse, au contraire, il émet des urines abondantes et hypotoniques.
Le mécanisme de la concentration des urines est mieux connu depuis les travaux de Wirz, Hargitay et Kuhn, qui ont montré, en 1951, qu’il s’expliquait en grande partie par la disposition anatomique des néphrons avec des anses de Henle recourbées en épingle à cheveux et des vaisseaux sanguins droits qui leur sont parallèles: cette disposition a quelque analogie avec des dispositifs de concentration utilisés de longue date dans l’industrie et désignés sous le nom de systèmes multiplicateurs à contre-courant.
Pour comprendre la portée de cette théorie du contre-courant appliquée au néphron, il faut se souvenir que des échanges passifs peuvent constamment se produire entre la lumière du tube (où se trouve l’urine), l’ambiance liquide nommée liquide interstitiel (au sein duquel se trouvent tubes et vaisseaux) et la lumière des vaisseaux (où se trouve le sang). Supposons alors que la réabsorption active du sodium dans la branche ascendante de l’anse de Henle accroisse l’osmolarité du liquide interstitiel et, par voie de conséquence, l’osmolarité de l’urine de la branche descendante. Si, en un point A de cette dernière (fig. 4), l’urine se trouve ainsi concentrée de 1 p. 100, cette urine légèrement plus concentrée continuera son chemin en épingle à cheveux, remontera dans la branche ascendante et, au point B de celle-ci, qui se trouve à la même hauteur que le point A de la branche descendante, c’est une urine déjà concentrée de 1 p. 100 qui sera à nouveau l’objet de la réabsorption active. Si bien qu’au cycle suivant une concentration de 1 + 1 = 2 p. 100 aura été obtenue, et ainsi de suite. Avec un pouvoir unitaire de réabsorption relativement faible, l’effet concentrateur se trouve donc multiplié grâce au système à contre-courant. Il faudrait un pouvoir infiniment plus grand pour obtenir la même concentration finale des urines s’il n’y avait pas ce dispositif multiplicateur.
Des preuves de cette hypothèse ont été apportées par deux groupes d’expérimentateurs. Wirz puis Ullrich ont établi que la pression osmotique du tissu rénal, étudiée sur des coupes stratifiées, augmente du cortex à la papille. Plus précisément, Gottschalk a montré, en 1967, que l’urine contenue dans les anses de Henle, le plasma sanguin renfermé dans les vaisseaux parallèles aux anses (vasa recta ) et l’urine des canaux collecteurs, recueillis par microponction, avaient la même osmolarité que le fluide interstitiel rénal recueilli au même niveau de la médullaire, et que la concentration en substances dissoutes était d’autant plus forte que l’on se rapproche de la pointe de la papille.
Le pouvoir de concentration ou de dilution de l’urine est sous la dépendance d’une hormone, l’hormone antidiurétique de l’hypophyse postérieure, ou ADH, dont la sécrétion est sollicitée chaque fois que l’organisme manque d’eau et que s’accroît l’osmolarité du plasma sanguin. Cette ADH a la propriété de rendre perméables à l’eau les cellules du tube distal et du collecteur et de provoquer ainsi une forte concentration des urines et une diminution de leur volume en facilitant l’appel d’eau vers l’ambiance extérieure au tube, laquelle est à cet endroit concentrée et hyperosmotique. L’absence pathologique de sécrétion d’ADH (diabète insipide) conduit à l’émission permanente d’urines anormalement diluées, dont le volume quotidien peut dépasser 10 l.
Réabsorption du sodium
La masse de sodium délivrée par l’ultrafiltrat glomérulaire à l’entrée du tube est supérieure à 500 g/j; l’excrétion de sodium, en régime normal, est de quelques grammes seulement par jour: plus de 99 p. 100 du sodium filtré sont donc réabsorbés au cours du transit tubulaire.
La réabsorption le long du tube contourné proximal est quantitativement la plus importante puisqu’elle correspond approximativement aux trois quarts de la charge apportée par le filtrat glomérulaire. Elle est «iso-osmotique», c’est-à-dire que le sodium, le chlore et l’eau sont réabsorbés en proportions équivalentes et que le fluide parvenant à l’extrémité du tube proximal a la même osmolarité que l’ultrafiltrat glomérulaire, comme l’ont montré les études par microponction de tubules (Gottschalk, 1961). Enfin, cette réabsorption est «active», car elle résulte d’une dépense d’énergie cellulaire, ce qui influence d’ailleurs la consommation d’oxygène par les reins.
Au cours de la traversée de l’anse de Henle, du sodium est encore réabsorbé dans la branche ascendante; cette réabsorption se fait, à cet endroit, sans réabsorption concomitante d’eau, si bien que l’osmolarité de l’urine est devenue légèrement plus basse à l’entrée du tube distal. Une réabsorption supplémentaire de sodium s’opère dans le tube contourné distal: bien que cette fraction ne représente qu’environ 10 p. 100 de la quantité filtrée par le glomérule, elle est très importante parce que ajustable, c’est-à-dire adaptable aux nécessités du maintien d’un sodium constant dans l’organisme, grâce à un contrôle hormonal précis qui en règle le degré.
La régulation de la réabsorption du sodium est, en effet, essentielle pour que la concentration sanguine et le capital de sodium dans l’organisme ne se modifient pas, quelles que soient les quantités ingérées. Cette régulation ne dépend que faiblement de variations de la filtration glomérulaire; l’autre facteur de variations, à savoir le système des hormones surrénales minéralo-corticoïdes [cf. ALDOSTÉRONE], est le facteur essentiel. Ces hormones, en particulier l’aldostérone, agissent essentiellement sur la réabsorption de sodium dans la branche ascendante de l’anse de Henle et le tube contourné distal: l’hormone stimule fortement cette réabsorption. La sécrétion de l’hormone par la zone glomérulée du cortex de la glande surrénale est elle-même stimulée par toute augmentation de sodium ou toute diminution de potassium dans le plasma sanguin; elle est aussi stimulée par l’adréno-corticotrophine hypophysaire, ou ACTH, hormone du lobe antérieur de l’hypophyse, dont la sécrétion est accrue par toute réduction de la masse de sang, grâce à des «barorécepteurs» placés en des points critiques de la circulation et sensibles aux variations du volume sanguin circulant; d’autre part, la sécrétion d’aldostérone est encore stimulée par la libération d’angiotensine, substance qui apparaît dans le sang sous l’influence de la rénine, elle-même sécrétée en abondance par le rein chaque fois qu’il y a réduction de la pression artérielle ou du volume sanguin circulant [cf. TENSION ARTÉRIELLE].
L’existence d’un troisième facteur qui, à l’inverse du précédent, accroîtrait l’excrétion de sodium par les reins, est encore discutée. Elle est soutenue par les travaux de De Wardener (1969), mais l’unanimité n’est pas encore faite sur ce point.
L’ensemble de cette régulation permet au rein normal un ajustement très précis de l’excrétion de sodium à l’ingestion de sodium: dans les conditions d’une restriction sodée alimentaire stricte, l’excrétion urinaire peut s’abaisser au-dessous de 0,10 g/j; en surcharge sodée, au contraire, l’excrétion urinaire dépasse parfois 15 g/j.
Excrétion des ions hydrogènes (H+):rôle du rein dans l’équilibre acidobasique
Le rein est chargé d’éliminer la production quotidienne d’ions H+ provenant du métabolisme, production qui est voisine de 1 mEq./kg de poids corporel, soit 70 mEq./j chez l’adulte. Ainsi, l’organisme se trouve protégé contre la menace constante d’acidose, qui ne serait que temporairement palliée par l’existence de substances tampons telles que les bicarbonates.
Le rein contrôle la concentration des bicarbonates du sang et autres liquides extracellulaires et, par là, la constance de l’équilibre acidobasique (ou, si l’on préfère, celle du pH), par trois mécanismes:
1. La réabsorption des bicarbonates filtrés. Elle est pratiquement totale lorsque le taux des bicarbonates ne dépasse pas 26 mEq./l dans le plasma sanguin, la totalité des bicarbonates filtrés étant réabsorbée. Lorsque le taux des bicarbonates dépasse 28 mEq./l («alcalose métabolique»), la réabsorption tubulaire est limitée et la fraction excédentaire des bicarbonates filtrés est éliminée par les urines. La réabsorption des bicarbonates se fait dans le tube proximal et se trouve sous la dépendance d’une enzyme, l’anhydrase carbonique. Les inhibiteurs de l’anhydrase carbonique (tels que l’acétazolamide) réduisent l’excrétion d’acides dans l’urine et provoquent la formation d’urines alcalines, riches en bicarbonate de sodium non réabsorbé.
2. La régénération des bicarbonates par excrétion d’acidité titrable. L’acidité titrable des urines (c’est-à-dire l’acidité mesurée par la quantité de solution alcaline qu’il est nécessaire d’ajouter pour obtenir la neutralisation) correspond dans la situation normale à l’élimination de 10 à 30 mEq. d’ions H+ par jour. Elle se fait principalement sous forme de phosphates monosodiques. Cette «acidité titrable» ne correspond pas forcément au pH urinaire, qui se trouve protégé contre un abaissement (c’est-à-dire une tendance acide) par une série de substances tampons.
3. La régénération des bicarbonates par excrétion d’ammoniac. L’ammoniac (NH3), gaz diffusible traversant facilement les membranes cellulaires, peut se combiner à un ion H+ pour former un ion ammonium NH4 qui sera éliminé par les urines.
L’ammoniac est synthétisé dans les cellules tubulaires, à tous les niveaux du tube, à partir de la glutamine; le sens de sa diffusion, vers les liquides péritubulaires ou vers la lumière tubulaire, varie en fonction des pH respectifs de l’urine et du sang; la diffusion, passive, se fait par gradient ionique, de la phase la plus alcaline vers la phase la plus acide. Dans les conditions physiologiques, les urines sont acides et l’élimination d’ions H+, sous forme de NH4, atteint de 30 à 50 mEq./j. En cas de surcharge acide, la formation d’ammonium par le rein peut décupler; à l’inverse, en cas d’alcalose par surcharge de corps basiques, l’ammoniogenèse diminue.
Au total, l’excrétion nette des ions H+ par l’urine s’exprime par l’équation suivante:
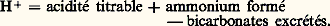
Excrétion des déchets du métabolisme azoté
L’urée est, chez l’homme, la forme principale d’élimination des déchets provenant du catabolisme azoté. L’urée filtrée est partiellement réabsorbée, par un processus passif de diffusion, au cours de son trajet dans le tube rénal. Toutefois, la réabsorption d’eau étant proportionnellement beaucoup plus importante que la réabsorption d’urée, cette dernière se trouve concentrée dans l’urine, le rapport de concentration U/P de l’urée urinaire à l’urée plasmatique pouvant atteindre de 50 à 100. La quantité d’urée éliminée par les urines dans les conditions normales est de l’ordre de 15 g/j, avec des variations du simple au double selon le régime alimentaire.
La créatinine urinaire est quantitativement moins importante, puisque son excrétion quotidienne est voisine de 1 g. Cette quantité est relativement fixe et ne dépend que de la masse musculaire du sujet considéré. La créatinine s’élimine par filtration glomérulaire pratiquement pure, la clearance étant de 120 ml/mn.
L’acide urique , qui provient du catabolisme des bases puriques, ne représente qu’une faible fraction des dérivés azotés éliminés par l’urine (de 500 à 1 000 mg/j). De l’acide urique filtré, 90 p. 100 sont réabsorbés par le tube proximal, selon un processus actif limité par un plafond de réabsorption tubulaire (15 mg/mn chez l’homme adulte). Une sécrétion distale active ajoute un peu d’acide urique à la fraction ayant échappé à la réabsorption proximale, mais celle-ci n’en maintient pas moins à des chiffres modérés le pouvoir d’excrétion d’acide urique par le rein.
Excrétion des autres constituants de l’urine
Bien d’autres substances ont une élimination qui se fait partiellement ou totalement par le rein: ainsi le potassium, les phosphates, le calcium, les acides aminés; quant aux protéines, elles sont pratiquement en totalité arrêtées par le rein.
La majeure partie du potassium filtré est réabsorbée par le tube proximal, comme l’ont montré les études par microponction tubulaire (Giebisch, Morel), si bien que le potassium excrété dans l’urine définitive provient essentiellement d’une sécrétion par le tube distal. La régulation du contrôle de l’excrétion du potassium est assurée par l’intermédiaire de la surrénale, sous l’action de l’aldostérone [cf. ALDOSTÉRONE].
La réabsorption des phosphates a lieu dans le tube proximal, suivant un mécanisme de transfert actif, limité par un plafond de réabsorption. La régulation de l’excrétion rénale des phosphates est sous la dépendance de l’hormone parathyroïdienne [cf. PARATHYROÏDES].
L’excrétion urinaire du calcium se fait à partir de la fraction ultrafiltrable du calcium plasmatique, c’est-à-dire environ 60 mg/l. La réabsorption se poursuit tout au long du tube. L’urine finale n’excrète que 1 p. 100 environ du calcium filtré. La régulation de la calciurie est sous la dépendance de deux facteurs principaux: la réabsorption du sodium par le tube proximal, la réabsorption du calcium lui étant proportionnelle (l’augmentation du volume du sang et des autres liquides extra-cellulaires entraîne simultanément une augmentation de l’élimination du sodium et du calcium); l’hormone parathyroïdienne, qui augmente la réabsorption distale du calcium sans modifier le taux de la réabsorption proximale.
Fonctions endocrines du rein
Le rein possède plusieurs fonctions endocrines, dont la connaissance est beaucoup plus récente que celle de ses fonctions d’excrétion et de régulation hydro-électrolytique.
La première sécrétion interne connue est la formation de rénine . Celle-ci est une substance enzymatique, sécrétée principalement par les appareils juxta-glomérulaires du rein mentionnés ci-dessus. Elle transforme une substance plasmatique fabriquée par le foie, l’angiotensinogène, en angiotensine I, octapeptide lui-même transformé par l’enzyme de conversion en angiotensine II, qui est l’agent vaso-constricteur le plus puissant connu. En outre, l’angiotensine est un stimulant de la sécrétion d’aldostérone par les glandes surrénales, aboutissant ainsi à une rétention du sodium urinaire. La rénine est sécrétée sous l’influence de la baisse de la pression artérielle dans l’artériole afférente des glomérules et par l’augmentation de la teneur en sodium de l’urine tubulaire au niveau de la macula densa. Ainsi, toute diminution du volume du secteur extracellulaire, de même que toute diminution du flux sanguin rénal sont compensées par une sécrétion d’angiotensine, qui rétablit la pression de perfusion normale des reins par son action vasoconstrictive et par la diminution de la fuite urinaire du sodium qu’elle induit.
Les effets vasoconstricteurs de l’angiotensine sur les vaisseaux intrarénaux sont contrebalancés, comme on le sait depuis peu, par la sécrétion de substances d’action vasodilatatrice, les prostaglandines. Ces substances sont sécrétées principalement dans la médullaire rénale, et elles expliquent l’action antihypertensive du rein, qui était connue de longue date, mais dont le mécanisme vient d’être élucidé.
La deuxième fonction endocrine du rein est la sécrétion d’érythropoïétine . Il s’agit d’une glycoprotéine ayant des propriétés érythropoïétiques, c’est-à-dire stimulant la production de globules rouges par la moelle osseuse (Naets). La diminution de la synthèse de cette protéine par les reins malades est une des principales causes de l’anémie observée au cours de l’insuffisance rénale chronique.
Une troisième fonction endocrine des reins est la conversion par une hydroxylase rénale de la vitamine D3, préalablement hydroxylée en position 25 par le foie, en dérivés actifs qui sont le 1-25 (OH)2 vit. D3 et la 24-25 (OH)2 vit. D3. Le 1-25 (OH)2 vit. D3 stimule l’absorption intestinale du calcium et favorise la minéralisation osseuse. Son défaut de synthèse, au cours de l’insuffisance rénale chronique, est une des causes majeures des altérations osseuses qui y sont observées.
2. Symptômes majeurs des maladies du rein et procédés d’exploration des fonctions rénales
Protéinurie
La protéinurie, autrefois désignée sous le nom d’albuminurie, est la présence dans l’urine de protéines en quantités supérieures aux traces normales (0,05 g/24 h). On décèle ce symptôme par l’apparition d’un précipité après chauffage des urines préalablement acidifiées et, s’il s’agit d’urines très peu concentrées, additionnées de chlorure de sodium.
Le débit de la protéinurie est estimé par diverses techniques de dosage (technique dite de la pesée, réaction du biuret, néphélémétrie). Il est exprimé soit en grammes par 24 heures, soit en milligrammes par minute. Une protéinurie est modérée lorsqu’elle ne dépasse pas 1 g/24 h; elle est abondante lorsqu’elle excède 4 à 5 g/24 h, soit 3 mg/mn.
Le débit de la protéinurie n’a pas de corrélation obligatoire avec la sévérité de l’affection rénale. En revanche, le type de la protéinurie peut avoir une signification diagnostique: l’étude par électrophorèse des fractions protéiques contenues dans l’urine permet, en effet, de distinguer des protéinuries « sélectives », où l’urine ne contient guère que de l’albumine proprement dite, et des protéinuries « non sélectives », où l’urine renferme un échantillonnage beaucoup plus varié et plus complet des protéines du plasma sanguin, albumine et globulines diverses.
Une variété de protéinurie est parfaitement bénigne: il s’agit de la protéinurie orthostatique observée chez l’adolescent. Elle est caractérisée par le fait qu’elle n’apparaît qu’en position debout et disparaît totalement en position allongée, les reins demeurant strictement normaux; elle survient au cours de la deuxième enfance ou de l’adolescence; elle disparaît habituellement à l’âge adulte.
Examen cytobactériologique des urines
L’examen microscopique du sédiment urinaire comporte la recherche de globules rouges, de globules blancs, de « cylindres » et de germes microbiens. Il est possible de quantifier ces données en exprimant le nombre des éléments figurés décelés dans l’urine en fonction du débit par minute.
Une hématurie microscopique est définie par un taux supérieur à 10 000 hématies par minute; au-delà de 1 à 2 millions d’hématies par minute, l’hématurie est macroscopique: les urines sont colorées en rouge. Chez le sujet normal, l’urine contient moins de 1 000 hématies et moins de 1 000 leucocytes par volume urinaire formé en 1 minute. L’abondance de l’hématurie, qu’elle soit microscopique ou macroscopique, n’a pas de corrélation avec la gravité de la maladie en cause. Toute hématurie est pathologique, c’est-à-dire qu’elle témoigne d’une lésion des reins ou de l’appareil urinaire. La constatation d’une hématurie doit amener une enquête néphrologique et urologique complète destinée à en trouver la cause. Celle-ci est soit une maladie des reins eux-mêmes (tumeur maligne ou bénigne, tuberculose, lithiase, maladie polykystique, glomérulonéphrite aiguë ou chronique, etc.), soit une atteinte des voies excrétrices: uretère, vessie, région urétro-prostatique (tumeurs bénignes ou malignes de la vessie, adénome ou cancer de la prostate, urétrite, lithiase des voies excrétrices).
Cependant, une hématurie microscopique minime, habituellement inférieure en débit à 30 000 hématies/ml, est fréquemment découverte par des examens systématiques (notamment au cours des visites médicales annuelles du travail) chez des sujets parfaitement sains, chez qui les explorations les plus attentives ne révèlent aucune uropathie ou néphropathie. Dans certains cas, de telles hématuries microscopiques peuvent être la traduction de l’élimination de cristaux ou de microcalculs qui justifient la recherche de facteurs favorisants, tels qu’une concentration excessive des urines en calcium ou en acide urique.
La constatation d’une leucocyturie pathologique, c’est-à-dire le passage de plus de 10 000 leucocytes par minute dans l’urine, est souvent associée à une infection urinaire. Celle-ci peut être le fait de germes très variés, y compris le bacille tuberculeux.
La recherche des germes urinaires se fait par examen microscopique des urines et par culture sur bouillon nutritif. À l’état normal, les urines ne contiennent aucun germe microbien. Lorsque existe une infection urinaire, c’est une faute de se contenter d’un traitement antimicrobien avant d’avoir procédé à une enquête attentive sur les sources et lieux de l’infection.
Examen radiologique des reins
L’urographie intraveineuse, c’est-à-dire l’opacification du parenchyme rénal et des voies excrétrices, par injection intraveineuse d’une substance de contraste iodée, apporte des indications précieuses en néphrologie.
La cystographie rétrograde consiste en l’opacification de la vessie après introduction d’une substance de contraste fluide par l’urètre. Chez l’homme, aujourd’hui, elle est le plus souvent remplacée par la cystographie suspubienne, qui consiste en l’introduction du liquide de contraste par un fin cathéter introduit dans la vessie quelques centimètres au-dessus du pubis, de manière à éviter tout risque d’infection. L’urétéropyélographie rétrograde consiste en l’instillation du produit de contraste par une sonde mise en place à l’orifice des uretères, après introduction d’un cystoscope dans la vessie.
L’artériographie rénale consiste en l’injection d’une substance de contraste à l’entrée des artères rénales par l’intermédiaire d’un cathéter mis en place dans une artère fémorale et introduit dans l’aorte, au-dessus du niveau d’origine des artères rénales. À l’heure actuelle, une nouvelle technique remplace souvent, en première intention, l’artériographie. Il s’agit de l’angiographie numérisée par voie veineuse, qui consiste en l’injection rapide du produit de contraste iodé par une veine et en l’enregistrement de l’opacification de l’artère rénale et de ses branches, grâce à un système de soustraction de l’image des tissus osseux et musculaires voisins par traitement «numérisé» sur ordinateur.
La phlébographie rénale consiste en l’introduction de produit de contraste par un cathéter introduit dans une veine fémorale, au pli de l’aine, et remonté dans la veine cave inférieure, au niveau de l’abouchement des veines rénales.
Examens échographiques
L’échographie, ou ultrasonographie, est un des progrès les plus importants dans l’exploration morphologique des reins et des voies excrétrices. Grâce à l’utilisation d’un faisceau d’ultrasons, les structures solides et liquidiennes des reins se différencient parfaitement. Il est ainsi possible de préciser la forme et la position des reins et de reconnaître une dilatation du bassinet et des calices, témoignant d’un obstacle des voies excrétrices, sans avoir à injecter de produit de contraste; cela est particulièrement précieux lorsque l’urographie intraveineuse est contre-indiquée chez un patient du fait d’une allergie sévère ou d’une insuffisance rénale qui ne permettraient pas d’obtenir une opacification suffisante des cavités rénales. L’échographie différencie parfaitement les masses intrarénales de nature liquidienne, telles que les kystes, des formations tumorales pleines.
L’échographie s’applique également à l’étude de la prostate, dont elle peut définir la taille et l’homogénéité.
Au total, l’urographie intraveineuse apporte des renseignements plus fins sur la morphologie des reins, des calices et des bassinets mais ne peut apporter d’indication sur la nature d’une masse intrarénale. À l’inverse, l’échographie n’apporte que des renseignements grossiers sur la morphologie des reins et des voies excrétrices, mais permet de reconnaître immédiatement la nature liquidienne ou solide d’une masse intrarénale. Ainsi, ces deux examens se complètent mutuellement, le choix de l’ordre dans lequel ils doivent être demandés dépendant du problème clinique posé par le patient.
Examens isotopiques
Le néphrogramme isotopique consiste en une injection par voie veineuse d’une substance excrétée par les reins et marquée par un corps radioactif, tel que l’hippuran marqué par l’iode 131, suivie de l’enregistrement des courbes de radioactivité obtenues par détecteurs externes placés en regard de chacun des deux reins. Grâce à cette méthode, on décèle une inégalité fonctionnelle entre les deux reins soit dans leur circulation (rétrécissement d’une artère rénale), soit dans leur excrétion (obstruction partielle d’un uretère).
La scintigraphie rénale permet de dessiner la forme des reins après administration de substances radioactives se fixant sur les cellules rénales, tels la néohydrine marquée par le mercure 197 ou l’ascorbate ferreux marqué par le technétium.
L’enregistrement séparé de la radioactivité fixée sur chacun des deux reins, ou scintigraphie rénale quantitative, permet d’estimer la valeur fonctionnelle relative des deux reins.
Explorations urologiques instrumentales
L’urétrocystoscopie permet d’examiner la muqueuse des voies urinaires basses, en particulier de l’urètre et de la vessie. Elle est donc fondamentale pour la recherche d’une tumeur bénigne ou maligne de la vessie, notamment en cas d’hématurie. La cystoscopie est le temps préalable à l’urétéropyélographie. Cet examen endoscopique, qui consiste en l’introduction d’un appareil métallique dans l’urètre, exige de rigoureuses précautions d’asepsie, pour éviter tout risque de déclenchement d’un accident infectieux. Il nécessite habituellement, chez l’homme, une anesthésie générale.
Ponction-biopsie du rein
Le fait que la plupart des affections rénales, et notamment les glomérulonéphrites, touchent de manière homogène la totalité des éléments constitutifs des reins explique qu’il soit possible d’obtenir des renseignements sur la structure des reins et leur pathologie par l’examen d’un minime fragment prélevant quelques dizaines de glomérules sur le million de glomérules que contient chaque rein. La pratique de cet examen, nommé biopsie rénale, a fait progresser de manière considérable nos connaissances sur les maladies rénales, en permettant de les étudier à un stade débutant. Il en résulte que le choix du côté biopsié, qu’il s’agisse du rein droit ou du rein gauche, est sans importance et est guidé uniquement par des considérations techniques.
Le prélèvement biopsique du rein se fait pratiquement toujours, à l’heure actuelle, à l’aide d’une aiguille introduite à travers la peau et les muscles, après anesthésie locale soigneuse des plans cutanés et musculaires traversés. Les repères sont pris sur les clichés urographiques. Il s’agit d’un examen indolore, qui n’a pratiquement pas d’autre contre-indication que l’existence d’un trouble de la coagulation ou du saignement (qui explique la nécessité d’un examen soigneux de l’hémostase), la trop petite taille d’un rein, ou encore l’existence d’un seul rein fonctionnel. Au cours de la biopsie sont prélevés deux ou trois minimes fragments, de 5 mm de longueur sur 1 mm de diamètre environ, afin de permettre l’examen en microscopie optique, en immuno-fluorescence et, si besoin, en microscopie électronique. La conjonction de ces différentes méthodes apporte une précision sans égale au diagnostic néphrologique. La biopsie rénale est un élément fondamental non seulement du diagnostic, mais aussi du pronostic et du choix du traitement dans les affections rénales, notamment glomérulaires.
Exploration fonctionnelle des reins
L’exploration fonctionnelle des reins est à la fois précise, simple et difficile: précise, car peu d’organes permettent une appréciation quantitative aussi rigoureuse de leur activité fonctionnelle; simple, car presque toujours fondée sur la comparaison du taux d’une substance dans le sang et dans l’urine; mais difficile et sujette à de nombreuses erreurs dans la pratique, car les résultats de toutes ces épreuves fonctionnelles peuvent être faussés si les urines formées par les reins pendant la durée de l’épreuve sont incomplètement recueillies ou si le débit de l’urine est insuffisant. La qualité de la réalisation de l’exploration fonctionnelle des reins dépend donc davantage du soin apporté au recueil des urines et du sang du malade que de la précision même des dosages chimiques nécessaires.
Dosages de l’urée et de la créatinine du plasma sanguin
Chez le sujet normal, le taux de l’urée sanguine est compris entre 4 et 9 mmol/l (de 0,25 à 0,55 g/l); un taux supérieur à 12 mmol/1 (0,70 g/l) témoigne habituellement d’une insuffisance rénale. La concentration de la créatinine plasmatique est, chez l’adulte, inférieure à 130 猪mol/l (14 mg/l); l’augmentation au-delà de 140 猪mol/l (15 mg/l) témoigne d’une insuffisance rénale débutante.
Mesure des clearances
La clearance rénale d’une substance est le rapport entre son débit dans l’urine et sa concentration dans le sang. La clearance s’exprime par la formule C = UV/P, dans laquelle U est la concentration de la substance dans l’urine, P la concentration dans le plasma, V le volume moyen d’urine émis par minute pendant la période considérée et C la clearance en millilitres par minute. Habituellement, l’épreuve se fait en deux périodes d’une heure chacune, le prélèvement plasmatique étant effectué à la fin de la première heure. Les substances dont la clearance est le plus souvent utilisée pour l’exploration fonctionnelle des reins sont l’urée et la créatinine.
La clearance de l’urée a une valeur normale de 60 ml/mn: au-dessous de cette valeur existe une insuffisance rénale. La clearance de l’urée est de mesure commode, mais elle est influencée par le volume de la diurèse: au-dessous d’un débit moyen de l’urine de 1,5 ml/mn, la clearance ne peut être valablement interprétée.
La clearance de la créatinine est normalement égale ou supérieure à 100 ml/mn chez l’adulte; cette valeur est très peu influencée par le volume de la diurèse, si bien que la clearance de la créatinine peut être mesurée à partir du recueil des urines des vingt-quatre heures effectué de manière ambulatoire. La valeur de la clearance de la créatinine est très voisine de celle de la filtration glomérulaire, dont elle fournit donc une estimation approximative mais très suffisante en clinique. Une mesure plus précise de la filtration glomérulaire pourrait être fournie par la mesure de la clearance de l’inuline, mais il s’agit d’une technique complexe, non utilisable en routine, servant uniquement de méthode de référence.
La clearance de l’acide para-amino-hippurique (PAH; substance qui, lorsqu’on l’infuse dans le sang à une concentration suffisamment faible, disparaît presque complètement du sang veineux rénal dès son premier passage dans le rein) permet de mesurer le flux plasmatique rénal. Plus précisément, lorsque le rein est assez intact pour réaliser une extraction très complète de cette substance, la clearance du PAH exprime en millilitres par minute la quantité de plasma sanguin qui irrigue les reins et permet ainsi d’en déduire la quantité de sang total irriguant ces organes.
Mesures de la capacité maximale d’activité tubulaire
La détermination de la quantité maximale de PAH excrétée par unité de temps par les tubes (Tm PAH) ou de la quantité maximale de glucose réabsorbée (Tm G) permet de mesurer la masse fonctionnelle active des reins; cette étude est complexe et n’est guère pratiquée que dans des laboratoires de recherches hautement spécialisés.
Épreuves de concentration et d’acidification provoquées des urines
La diminution du pouvoir de concentration urinaire est souvent la première conséquence d’une insuffisance rénale; la preuve peut en être fournie par une étude de la capacité maximale de concentration des urines obtenues par restriction des boissons; chez le sujet normal, après une restriction hydrique stricte pendant les huit heures d’une nuit, la densité des urines doit atteindre au moins 1,025, l’osmolarité urinaire doit dépasser 800 milliosmoles par litre.
L’épreuve d’acidification urinaire provoquée met en évidence un éventuel défaut de l’aptitude des reins à éliminer une charge acide: elle utilise le chlorure d’ammonium ou le chlorhydrate d’arginine, au cours d’épreuves généralement complexes relevant de l’investigation clinique spécialisée.
Expression des résultats chez l’enfant
Les résultats normaux des valeurs des clearances indiquées pour l’adulte doivent être corrigés lorsqu’il s’agit d’un enfant. Cette correction se fait généralement par calcul de la surface du corps, grâce à des tables qui fournissent ce chiffre en fonction de la taille et du poids; on rapporte ensuite le résultat de l’épreuve fonctionnelle rénale au mètre carré de surface corporelle, en sachant que les chiffres indiqués ci-dessus pour l’adulte correspondent à une surface corporelle moyenne d’adulte estimée à 1,73 m2.
3. Grands syndromes néphrologiques
Le syndrome néphrotique
Le syndrome néphrotique se définit par la conjonction de quatre éléments: une protéinurie abondante, supérieure à 3g/24 h; une baisse du taux des protéines du plasma sanguin, affectant électivement l’albumine, dont le taux s’abaisse au-dessous de 30 g/l; une élévation du taux des graisses plasmatiques, et notamment du cholestérol; enfin, une tendance aux œdèmes. L’œdème n’est pas absolument constant dans les syndromes néphrotiques, mais il y est très fréquent et parfois même très volumineux, entraînant une bouffissure généralisée et infiltrant, d’un liquide pauvre en albumine, les cavités séreuses telles que la plèvre ou le péritoine. Cet ensemble de signes cliniques et humoraux est assez singulier pour qu’on l’étudie à part. Mais c’est un syndrome ayant diverses causes et non une maladie. Au début du siècle, on n’en jugeait pas ainsi et l’on désignait sous le nom de «néphrose lipoïdique» l’entité morbide qu’on croyait autonome. C’est peu à peu que s’est dégagée l’idée que le syndrome néphrotique pouvait apparaître chaque fois que le rein laissait passer dans l’urine une grande quantité d’albumine, quelle que soit la cause de cette faillite du pouvoir qu’a le rein normal de s’opposer à la fuite de l’albumine du sang. Comme la paroi des capillaires glomérulaires est normalement le filtre d’arrêt qui s’oppose à la fuite des protéines plasmatiques dans l’urine, il est naturel que les causes de syndrome néphrotique soient essentiellement des maladies qui altèrent cette paroi. Mais il peut s’agir de causes fort différentes les unes des autres: «glomérulonéphrites» diverses, diabète, maladie amyloïde, lupus érythémateux disséminé, thrombose des veines rénales et bien d’autres, y compris, dans un nombre encore fort élevé de cas, des situations pathologiques de nature tout à fait inconnue.
L’enchaînement des symptômes composant le syndrome néphrotique à partir d’une fuite urinaire d’albumine est à peu près élucidé; le premier chaînon est une baisse de l’albumine du plasma sanguin qui réduit la pression osmotique des protéines du plasma (ou pression «oncotique»). Celle-ci favorise l’extravasation de l’eau plasmatique vers les liquides interstitiels, c’est-à-dire l’œdème; ce dernier est également favorisé par une sécrétion excessive d’aldostérone, provoquée par la réduction du volume de plasma circulant, elle-même conséquence de la perte du capital d’albumine. Enfin, l’accélération de la synthèse de l’albumine par les cellules hépatiques, en réponse à la déperdition urinaire, s’accompagne de troubles du métabolisme intermédiaire des hydrates de carbone et des lipides, qui expliquent aujourd’hui de manière cohérente l’augmentation des graisses du sang. Elle s’accompagne également d’une augmentation de la synthèse des facteurs de la coagulation, qui est l’un des éléments favorisant la survenue d’accidents de thrombose vasculaire parfois observés au cours des syndromes néphrotiques.
Hypertension artérielle d’origine rénale
Une hypertension artérielle accompagne un grand nombre de maladies des reins parvenues ou non au stade de l’insuffisance rénale. Schématiquement, une hypertension artérielle s’observe dans certaines maladies touchant les deux reins, mais aussi dans certaines lésions rénales unilatérales et, enfin, dans certaines anomalies des artères rénales. L’intérêt de la distinction réside dans le fait que l’hypertension artérielle relevant d’une cause unilatérale, portant sur le rein ou sur son artère, est curable par ablation du rein fautif ou par correction de la lésion artérielle causale. En revanche, le traitement de l’hypertension artérielle accompagnant les lésions bilatérales des reins n’est fréquemment qu’un palliatif.
L’hypertension dite «réno-vasculaire», c’est-à-dire secondaire à un rétrécissement des artères rénales, a fait l’objet d’une somme importante de travaux depuis 1945. Le point de départ fut le travail de Goldblatt montrant qu’on pouvait créer une hypertension artérielle chez le chien par striction partielle d’une artère rénale. L’analogie de ce modèle expérimental avec certaines hypertensions artérielles humaines fut ensuite démontrée grâce à l’artériographie, qui permet de visualiser les réductions de calibre des artères rénales. Cette variété d’hypertension est souvent curable.
L’insuffisance rénale aiguë
La suppression brutale de la fonction des reins, quelle qu’en soit la cause, est souvent (mais non toujours) accompagnée d’un tarissement des urines que l’on désigne du terme d’anurie.
Les possibilités d’action du médecin dans l’insuffisance rénale aiguë ont été bouleversées par l’introduction du rein artificiel dans les moyens thérapeutiques. En effet, l’expérience a montré que la défaillance aiguë des reins était très souvent un état transitoire, suivi d’une récupération spontanée de la fonction rénale après un délai de quelques jours ou de quelques semaines, à condition que le malade ait pu être maintenu en vie au cours de la période d’insuffisance rénale aiguë. Quelle que soit la cause de l’insuffisance rénale aiguë, elle se traduit toujours par une urémie aiguë: l’élévation du taux de l’urée sanguine, d’autant plus forte que la maladie causale entraîne une plus grande destruction tissulaire génératrice de produits de déchets azotés, est d’ordinaire de l’ordre de 0,50 à 1 g par litre de sang et par jour. Il s’y associe une acidose, liée à la rétention des radicaux acides produits par le métabolisme, et une anémie, conséquence de la brutale cessation d’activité érythropoïétique de la moelle osseuse. L’équilibre de l’eau et des électrolytes n’est plus assuré que par la régulation des apports, d’où le risque de distorsions graves si ces apports ne sont pas strictement contrôlés.
Les causes de l’insuffisance rénale aiguë sont multiples. Les trois catégories principales sont les suivantes :
1. Des obstacles siégeant sur la voie excrétrice, qu’il s’agisse de l’obstruction par un calcul de l’uretère d’un rein qui était seul à assurer la fonction excrétrice (l’autre rein étant soit congénitalement absent, soit chirurgicalement enlevé, soit lui-même altéré) ou de la compression des voies urinaires (par exemple, compression par une tumeur). Dans tous ces cas, seule la suppression de l’obstacle peut obtenir le rétablissement des urines et la reprise des fonctions des reins. À l’inverse, un obstacle négligé conduirait à la destruction lente et irréversible du rein correspondant.
2. Les insuffisances rénales «fonctionnelles», conséquence de désordres circulatoires aigus modifiant la perfusion du sang dans le rein, ou de désordres de l’eau et des électrolytes altérant la composition du plasma qui irrigue les reins. Dans les deux cas, il ne s’agit pas d’une lésion profonde des reins, mais d’un vice de fonctionnement dû à ce que ne sont plus réunies les conditions exigées par le rein pour une fonction efficace. L’anomalie rénale est donc immédiatement réversible si l’on rétablit des conditions circulatoires ou humorales normales. Les urémies par manque de sel sont l’exemple le plus ancien et le plus traditionnel de ces faits.
3. Les néphrites tubulo-interstitielles aiguës, de cause toxique ou infectieuse, représentent un troisième groupe où l’insuffisance rénale relève d’une altération grave des reins. Elles seront étudiées plus loin.
Le traitement comporte deux ordres de mesures: d’une part, la suppression ou la correction de la cause de l’insuffisance rénale aiguë, lorsque cela est possible; d’autre part, le traitement palliatif, indispensable tant que dure l’arrêt de la fonction des reins: réduction des apports d’eau et d’électrolytes, usage de résines échangeuses d’ions et, surtout, procédés d’épuration extra-rénale par dialyse péritonéale ou rein artificiel. La dialyse péritonéale consiste en l’utilisation de la séreuse péritonéale comme membrane d’échange entre le milieu liquide intérieur du malade et une solution électrolytique de composition choisie, voisine de celle du plasma normal, introduite dans la cavité péritonéale, puis évacuée après qu’elle s’est chargée d’urée et autres substances à éliminer. Le rein artificiel met en présence le sang du malade avec la solution de dialyse par l’intermédiaire d’une membrane semi-perméable. Cette dernière technique a le rendement d’extraction d’urée le plus élevé et la plus grande rapidité de correction des désordres hydro-électrolytiques. Dans certaines insuffisances rénales aiguës, des séances répétées d’épuration extra-rénale sont nécessaires, parfois pendant de longues semaines, avant que la récupération spontanée de la fonction des reins permette la guérison (cf. infra , chap. 5).
L’insuffisance rénale chronique
L’insuffisance rénale chronique est l’aboutissant possible de la plupart des maladies rénales bilatérales. Elle traduit la lente dégradation de la fonction des reins malades, conséquence de l’altération progressive des unités néphroniques actives du rein. Expérimentalement, l’insuffisance rénale n’apparaît chez l’animal que lorsqu’une quantité suffisante de parenchyme rénal a été enlevée: par exemple, ablation d’un rein et du tiers de l’autre rein. Il est remarquable que, dans ces cas, on n’observe pas une réduction du volume des urines, mais l’augmentation de ce volume (ou polyurie) par perte de la fonction de concentration urinaire.
Cette image de l’insuffisance rénale par amputation d’une partie du tissu rénal est-elle applicable à l’homme? Les maladies du rein provoquent-elles généralement l’insuffisance rénale par altération progressive de tous les néphrons ou, au contraire, en diminuant le nombre des néphrons actifs, mettent-elles certains d’entre eux totalement hors de fonction, tandis que d’autres restent intacts? Cette dernière hypothèse, souvent dénommée «théorie du néphron intact» (Neal Bricker, 1960), est sans doute applicable, chez l’homme, à de très nombreux cas.
Les conséquences de l’insuffisance rénale chronique sont d’abord une diminution latente de la valeur des épreuves fonctionnelles rénales telles que les clearances de l’urée et de la créatinine. À ce moment, aucune manifestation clinique ne vient encore traduire la baisse de la fonction rénale. Puis, peu à peu, se développe une urémie chronique. Il y a rétention de l’urée et de la créatinine, dont les taux sanguins s’élèvent. L’acide urique plasmatique est également augmenté, de même qu’une série d’autres substances azotées. L’urée n’est guère toxique par elle-même jusqu’à des taux très élevés; les manifestations de l’urémie chronique sont sans doute secondaires à la rétention d’autres dérivés azotés tels que des polypeptides encore mal identifiés, des dérivés guanidiques, des phénols, etc.
À la rétention azotée s’ajoutent une acidose, constante et lentement progressive, une tendance fréquente à l’augmentation du taux de potassium plasmatique, ou hyperkaliémie, plus rarement une hypokaliémie, enfin, une rétention des phosphates et des sulfates, associée à une baisse du calcium dans le plasma sanguin.
Les principaux troubles cliniques qu’entraînent ces désordres biochimiques de l’urémie chronique sont: une anémie, symptôme tellement constant qu’il est parfois révélateur d’une insuffisance rénale méconnue; des troubles digestifs, inappétence, nausées ou vomissements, parfois stomatite ou parotidite au stade ultime; un prurit, signe très anciennement connu mais fort inconstant, expliqué peut-être par la présence de dépôts phosphocalciques dans le derme et l’épiderme; une péricardite, observée seulement à des stades avancés de l’urémie; une altération des plaquettes sanguines, responsable d’une tendance au saignement. Une atteinte osseuse peut se développer au cours de l’insuffisance rénale chronique, en particulier dans les formes très lentement évolutives: elle se caractérise par une déminéralisation osseuse généralisée et paraît liée surtout à un hyperfonctionnement des glandes parathyroïdes, conséquence réactionnelle de l’élévation du taux des phosphates, et à l’abaissement du calcium dans le plasma sanguin. La croissance est fréquemment perturbée chez l’enfant, expliquant le retard statural constaté chez les sujets frappés d’une insuffisance rénale dès leur jeune âge (nanisme rénal). Enfin, des troubles neurologiques peuvent exister, les uns frappant le système nerveux central (asthénie et somnolence), les autres les nerfs périphériques: c’est la polynévrite urémique.
À vrai dire, beaucoup d’urémies chroniques demeurent latentes et n’entraînent, pendant longtemps, que peu de troubles apparents. Bien plus, lorsque des manifestations cliniques apparaissent chez ces malades, elles sont souvent la conséquence moins de l’urémie que de l’hypertension artérielle que provoque parfois la même maladie rénale et qui peut être génératrice d’insuffisance cardiaque ou d’accidents oculaires ou neurologiques.
4. Principales maladies rénales
Glomérulonéphrites
Les glomérulonéphrites sont définies par une atteinte élective et majoritaire des glomérules.
Les glomérulonéphrites aiguës sont de connaissance ancienne: leur tableau clinique est caractéristique, mais leur substrat anatomique n’est bien connu que depuis la pratique des biopsies rénales. Dans les formes habituelles, la glomérulonéphrite aiguë est précédée par une infection rhinopharyngée, par exemple une angine, le plus souvent à streptocoques; une dizaine de jours s’écoulent, puis apparaissent des douleurs lombaires, des œdèmes, une diminution de volume des urines qui prennent une couleur foncée. On y découvre une protéinurie abondante, des hématies en grand nombre, des cylindres. Une élévation passagère de la tension artérielle s’y associe fréquemment, de même qu’une rétention azotée transitoire. L’évolution est spontanément favorable dans la majorité des cas, au prix d’une restriction simple d’eau et de sel. La guérison est le plus souvent totale, sans séquelles; parfois persistent des signes d’évolutivité, et une glomérulonéphrite chronique peut succéder, dans ces cas, à l’épisode aigu.
La biopsie rénale, dans la glomérulonéphrite aiguë, montre un aspect histologique caractéristique: prolifération exclusive et franche des cellules intercapillaires des glomérules, avec de petits dépôts en forme de chapeau sur la face externe de la paroi des capillaires; de nombreux leucocytes polynucléaires peuvent aussi se voir dans les lumières capillaires.
Il existe une variété de néphrite glomérulaire aiguë, désignée sous le nom de «glomérulonéphrite rapidement progressive». Il s’agit ici d’une atteinte glomérulaire avec insuffisance rénale précoce ou même anurie. La biopsie rénale montre des lésions très différentes de la variété précédente: prolifération considérable des cellules épithéliales de la capsule de Bowman de tous les glomérules, associée à des dépôts de fibrine. La destruction des glomérules est parfois totale et irréversible; ailleurs, l’atteinte des glomérules est partielle et compatible avec une survie prolongée et une régression de l’insuffisance rénale.
Le groupe des glomérulonéphrites chroniques est un monde complexe, où les spécialistes distinguent de nombreuses variétés, fort différentes les unes des autres. On n’en définira ici que quelques types essentiels.
Les «syndromes néphrotiques avec lésions glomérulaires minimes» constituent une maladie fréquente, mais d’origine inconnue. L’examen histologique des reins ne montre, pour toute anomalie, que des altérations visibles en microscopie électronique des cellules recouvrant la face externe de la paroi des capillaires glomérulaires. La maladie est souvent totalement curable, notamment avec l’aide des dérivés de la cortisone.
Les dépôts extra-membraneux, ou «glomérulites extra-membraneuses», se traduisent, elles aussi, fréquemment par un syndrome néphrotique, mais celui-ci est résistant aux médicaments corticoïdes. La biopsie rénale montre sur le versant externe de la membrane basale, qui forme la charpente de la paroi des capillaires glomérulaires, des dépôts d’immunoglobulines et de complément sérique. Assez souvent, l’évolution se fait, lentement, vers la guérison.
Les glomérulonéphrites chroniques «prolifératives» et «membrano-prolifératives» sont fréquentes. Leur origine est parfois infectieuse, mais souvent inconnue. Dans cette variété existent une protéinurie, accompagnée inconstamment d’un syndrome néphrotique, et une hématurie microscopique; l’hypertension artérielle est fréquente; la tendance à l’aggravation est constante. La biopsie rénale révèle une prolifération (c’est-à-dire un nombre accru) des cellules des glomérules accompagnée de dépôts intercapillaires.
Les dépôts intercapillaires, ou mésangiaux, d’immunoglobulines sont une maladie individualisée par J. Berger en 1969 et caractérisée par la présence de dépôts d’immunoglobulines A et G dans la tige, ou zone mésangiale, des glomérules. Seules les techniques dites d’immunofluorescence permettent de déceler ces dépôts. Cette variété de maladie rénale est fréquente; elle se traduit par une protéinurie minime, associée à une hématurie microscopique, émaillée d’épisodes d’hématuries macroscopiques, survenant le jour même d’angines ou d’infections rhinopharyngées. Elle est, dans la grande majorité des cas, bénigne et n’évolue pas habituellement vers l’hypertension artérielle et l’insuffisance rénale.
Bien d’autres variétés de néphropathies glomérulaires chroniques ont été décrites. On doit notamment signaler les formes dites secondaires à une maladie générale telle que le lupus érythémateux disséminé, le purpura rhumatoïde, la maladie amyloïde, le diabète sucré, etc.
Nombre de glomérulonéphrites ont un mécanisme immunologique : en d’autres termes, elles constituent la conséquence malheureuse d’une immunisation de l’organisme soit contre lui-même (auto-immunité), soit contre des «antigènes» étrangers, par exemple microbiens.
Le premier mécanisme est le développement d’une auto-immunité du sujet contre les membranes basales de ses propres capillaires glomérulaires: dans cette variété apparaissent des dépôts linéaires endocapillaires d’immunoglobulines; l’exemple le plus démonstratif est celui du syndrome dit de Goopasture, qui associe une glomérulonéphrite grave et une atteinte aiguë du poumon avec hémoptysie et où l’immunisation se produit à la fois contre les membranes basales des alvéoles pulmonaires et celles des capillaires glomérulaires.
Un second mécanisme, sans doute beaucoup plus fréquent, est le dépôt dans les reins de «complexes antigènes-anticorps» circulants; l’antigène est de nature quelconque, par exemple un virus; l’anticorps formé par l’organisme contre cet antigène se fixe sur ce dernier sous forme de «complexes» qui circulent dans le sang et, dans certaines conditions de taille et d’affinité, peuvent se fixer dans les glomérules rénaux et y constituer un point d’appel pour des lésions plus ou moins sévères.
Cette explication des glomérulonéphrites humaines est très généralement acceptée, par extrapolation de modèles expérimentaux dus notamment à l’équipe de Frank Dixon aux États-Unis. Elle prête cependant le flanc à diverses critiques et les travaux de l’école française indiquent qu’il y faut apporter au moins une série de corrections et de compléments auxquelles de nombreuses recherches ont été consacrées.
Néphropathies tubulaires et interstitielles
Les néphrites tubulo-interstitielles aiguës (ou tubulonéphrites aiguës, ou nécroses tubulaires aiguës) sont la cause la plus fréquente d’insuffisance rénale aiguë anurique. Elles relèvent de trois catégories de causes. En premier lieu, des intoxications, telles que l’intoxication par des sels de mercure ou de bismuth, par le tétrachlorure de carbone ou de diéthylène-glycol (antigel). À l’heure actuelle, la cause la plus fréquente tient à l’usage, à doses excessives, de certains antibiotiques, notamment les aminosides tels que la gentamicine, ou à l’utilisation de produits de contraste iodés à forte dose. La deuxième cause des néphrites tubulaires aiguës est constituée par les états de choc observés au cours des traumatismes sévères et des infections graves, notamment certaines septicémies, les avortements septiques, les hémolyses massives par transfusion incompatible ou provoquées par des toxiques tels que l’hydrogène arsénié ou le chlorate de potasse.
Il existe également des néphrites interstitielles aiguës d’origine immuno-allergique, principalement provoquées par des médicaments, notamment l’ampicilline, les sulfamides, certains anticoagulants et certains analgésiques tels que la glafénine.
La traduction clinique commune de ces agressions rénales est la survenue d’une insuffisance rénale aiguë, avec très souvent arrêt de la formation d’urine. L’examen histologique montre des lésions prédominant sur les tubes, en particulier les tubes distaux, avec nécrose cellulaire et une réaction interstitielle, faite d’œdème et d’infiltration cellulaire.
La particularité de cette variété d’atteintes rénales est d’être habituellement réversible, c’est-à-dire d’évoluer spontanément vers la régénération des cellules tubulaires détruites et la reprise d’une fonction rénale normale, sans séquelle, à la condition que le patient puisse surmonter sans encombre la phase critique d’urémie aiguë; c’était exceptionnel autrefois, c’est habituel aujourd’hui, grâce au rein artificiel.
La pyélonéphrite aiguë est l’infection aiguë des cavités excrétrices du rein (bassinet et calice), associée à une infiltration septique des reins propagée à partir des cavités; elle est favorisée par les obstacles des voies excrétrices, par exemple des calculs; elle se voit plus fréquemment chez la femme que chez l’homme: elle survient volontiers au cours de la grossesse, plus souvent du côté droit, sans doute favorisée par la gêne à l’évacuation de l’uretère, fréquente au cours de la grossesse. La pyélonéphrite aiguë est marquée par des lombalgies, de la fièvre, des urines purulentes. Le traitement antibiotique amène la guérison s’il n’existe pas de cause permanente susceptible d’entraîner une récidive.
Les pyélonéphrites chroniques sont la conséquence d’une infection permanente des voies excrétrices, propagée au parenchyme rénal. Elles sont favorisées par toutes les causes de stase des voies excrétrices: c’est dire que calculs urinaires et malformations congénitales des voies urinaires, gênant le cours normal de l’urine, en sont des causes fréquentes. Cette variété de maladies rénales peut évoluer vers une insuffisance rénale, en général très lentement progressive, parfois accompagnée d’hypertension artérielle.
Il existe aussi des néphropathies interstitielles chroniques d’origine non infectieuse , liées en particulier à la prise prolongée d’analgésiques contenant de la phénacétine.
Néphroangioscléroses et autres lésions rénales d’origine vasculaire
On définit sous le nom de néphroangiosclérose le retentissement secondaire sur le rein d’une hypertension artérielle permanente. Cette situation est distincte de celle où l’hypertension artérielle est la conséquence, et non la cause, de la maladie rénale. Dans la néphroangiosclérose, l’hypertension est souvent «primitive», c’est-à-dire sans cause acquise connue. L’atteinte secondaire du rein, qui se produit dans 20 à 30 p. 100 des hypertensions artérielles communes, se caractérise par l’apparition d’une protéinurie modérée et d’une hématurie microscopique, puis du développement d’une insuffisance rénale progressive. La biopsie rénale, lorsqu’elle est faite, montre un épaississement des parois des artérioles rénales réduisant leur lumière; dans les zones irriguées par les artérioles pathologiques, les tubes, l’interstitium et les glomérules sont altérés. Cette évolution est habituellement lente et l’atteinte du rein elle-même n’apparaît qu’après de longues années de l’évolution d’une hypertension artérielle.
Une variété cependant est d’évolution grave et rapide: c’est la néphroangiosclérose maligne; le développement de l’insuffisance rénale y est explosif et conduit en quelques mois à l’urémie. Les lésions histologiques des reins sont caractérisées par une nécrose de la paroi de toutes les artérioles du rein.
La microangiopathie thrombotique , ou syndrome hémolytico-urémique, a pour traduction clinique habituelle une anurie associée à une anémie sévère et à une diminution du nombre des plaquettes du sang circulant. Les lésions histologiques du rein sont singularisées par une nécrose de la paroi des petites artérioles, dont beaucoup sont oblitérées par des caillots, et des altérations spéciales de la paroi des capillaires glomérulaires. Le pronostic est sévère dans la plupart des cas.
Les nécroses corticales bilatérales des reins constituent une autre variété très grave d’atteinte rénale, observée soit dans le cadre de l’affection précédente, soit à la suite d’accidents de la grossesse et de l’accouchement. Elles sont définies par une modification de la corticale des deux reins qui, lorsqu’elle est diffuse et importante, entraîne une anurie irréversible.
Les maladies rénales héréditaires et familiales et les anomalies congénitales du rein
Les maladies héréditaires et familiales des reins sont nombreuses.
Les tubulopathies chroniques sont des anomalies congénitales de l’équipement enzymatique des cellules tubulaires, à transmission le plus souvent héréditaire. Ces affections se décèlent en général chez l’enfant ou l’adolescent. Le « diabète insipide pitresso-résistant» se manifeste par des urines très anormalement abondantes et diluées, parce que les tubes rénaux ne sont plus capables de répondre à l’hormone antidiurétique hypophysaire. Le «diabète rénal» est une fuite de sucre dans l’urine, alors que le sucre sanguin est normal; il exprime une défaillance de la réabsorption tubulaire du glucose. La «cystinurie-lysinurie» est une fuite urinaire excessive de deux amino-acides, la cystine et la lysine; elle peut entraîner la formation de calculs de cystine. L’«acidose tubulaire chronique» traduit un vice de la régulation tubulaire de l’élimination des acides; elle entraîne souvent des dépôts calcaires à l’intérieur des reins et conduit dans sa forme la plus sévère à une insuffisance rénale progressive.
La néphronophthise héréditaire , décrite par Fanconi en 1951, est marquée par une fibrose interstitielle diffuse et progressive des reins.
Les néphropathies familiales avec surdité , ou syndrome d’Alport, associent une atteinte rénale, une surdité et parfois certaines anomalies du cristallin de l’œil.
La polykystose rénale est aussi une maladie héréditaire. Elle est définie par le développement dans les reins de kystes innombrables, qui créent peu à peu des reins énormes où les néphrons sont progressivement étouffés par le développement kystique. L’évolution vers l’insuffisance rénale est cependant assez lente pour qu’on ait rarement à recourir à la dialyse périodique ou à la greffe d’un rein normal avant l’âge de cinquante ans.
Bien d’autres malformations et anomalies diverses du rein peuvent être observées: rein unique congénital, rein surnuméraire ou dédoublé , symphyse rénale ou rein «en fer à cheval» , ectopie rénale ou position anormale du rein dans la région pelvienne, rein en éponge , etc.; ce sont des anomalies congénitales, mais rarement héréditaires. L’hypoplasie rénale segmentaire , marquée par un trouble de développement de certaines régions du rein tandis que les autres sont intactes, est importante comme cause possible d’hypertension artérielle de l’enfant.
Atteintes rénales au cours de la grossesse
La néphropathie gravidique vraie se caractérise par sa survenue chez une femme primipare indemne de tout antécédent de maladie rénale ou d’hypertension artérielle et par sa manifestation seulement au dernier trimestre de la grossesse. Elle est annoncée par l’apparition de protéines dans l’urine, d’œdèmes et d’hypertension; ces symptômes vont de pair avec une altération glomérulaire particulière, un gonflement œdémateux des cellules de la paroi des capillaires glomérulaires. Si l’on n’applique pas les mesures thérapeutiques désirables, des accidents convulsifs, désignés sous le nom d’éclampsie, peuvent se produire, avec mort de l’enfant et possibilité de complications graves pour la mère. Mais si cette période critique est passée, tout disparaît dans les jours suivant l’accouchement et la maladie guérit sans séquelle. Elle ne récidive pas lors des grossesses ultérieures.
Cette néphropathie gravidique vraie doit être distinguée des accidents rénaux que présentent parfois, au cours d’une grossesse, les femmes atteintes antérieurement d’une hypertension artérielle permanente; dans ce cas, les premiers signes (protéinurie, œdèmes, etc.) se manifestent habituellement dès les premiers mois de la grossesse, la femme est souvent une multipare, l’accouchement n’est pas suivi d’un retour à la normale et des accidents analogues ont tendance à se reproduire grâce à la prévention des grossesses ultérieures. Ces maladies sont devenues plus rares.
Entre ces deux variétés apparemment si différentes de complications rénales de la grossesse, il existe diverses formes intermédiaires qui échappent au schéma qu’on vient de rappeler. En outre, les grossesses exposent au risque d’infection urinaire, et en particulier de pyélonéphrite.
La lithiase rénale
Les conséquences de la lithiase urinaire, c’est-à-dire les accidents liés à la migration de calculs dans les uretères ou à l’infection des calculs, sont étudiées dans l’article UROLOGIE, de même que le traitement chirurgical des calculs et les principes de leur ablation par voie transcutanée ou de leur destruction par les ultrasons ou par des ondes de choc (lithotritie). Cependant, la formation des calculs relève de facteurs de mieux en mieux connus. Il en résulte qu’une prévention de la récidive des calculs est désormais possible. C’est l’affaire du néphrologue de conduire les investigations nécessaires à la reconnaissance des facteurs favorisant la lithogenèse.
La plus fréquente des variétés de lithiases est la lithiase calcique: les calculs y sont faits d’oxalate ou de phosphate de calcium. Leur cause principale est une concentration excessive des urines en sels de calcium, relevant souvent d’un excès des apports alimentaires en produits laitiers, très riches en calcium. Souvent aussi, il s’agit d’un trouble inné de la réabsorption tubulaire rénale du calcium, ou hypercalciurie idiopathique , qui ne peut être corrigé par la seule restriction des apports alimentaires en calcium. L’usage prolongé des diurétiques thiazidiques, qui ont la propriété d’augmenter la réabsorption tubulaire du calcium, permet dans ce cas, en association avec une diurèse abondante, de maintenir la concentration du calcium urinaire au-dessous de la zone dangereuse. On conçoit aisément que la prise d’eau de Contrexéville, très riche en calcium, soit déconseillée chez les malades atteints de lithiase calcique.
Quant à la lithiase urique, elle est favorisée par un excès de la concentration des urines en acide urique et, surtout, par l’acidité excessive des urines. Son traitement préventif repose sur une alcalinisation permanente des urines, qu’il est aisé d’obtenir par la prise d’une à deux bouteilles d’eau de Vichy par jour (cette eau étant riche en bicarbonates) et, en cas d’augmentation excessive de l’acide urique urinaire, par la prise d’inhibiteurs enzymatiques de la synthèse de l’acide urique.
5. Traitement des maladies rénales
Le traitement des maladies rénales comporte trois catégories d’action possible: le traitement des causes de la maladie; celui de ses conséquences; enfin, les méthodes de remplacement des reins lorsque ceux-ci sont détruits.
Traitement des causes de l’altération rénale
Supprimer la cause de l’altération des reins est parfois possible. Il en est ainsi en cas d’infections spécifiques telles qu’une tuberculose curable par les antibiotiques, en cas de calculs urinaires que le chirurgien peut enlever et dont le médecin peut empêcher le retour si la formation des calculs a une cause que l’on peut corriger.
Dans les glomérulonéphrites, on est relativement désarmé quant au traitement de la cause, sauf dans certaines formes secondaires à une maladie générale justiciable d’un traitement spécifique: par exemple, usage des corticoïdes et des drogues dites immunosuppressives dans la néphrite du lupus érythémateux disséminé.
Traitement des conséquences de l’altération rénale
C’est le traitement antihypertenseur quand la maladie entraîne une hypertension artérielle, et c’est surtout le traitement de l’insuffisance des fonctions rénales. Ce traitement repose tout d’abord sur des précautions de régime: limitations dans l’apport d’azote, d’eau et de sodium, ajustées aux possibilités d’excrétion du rein. C’est ainsi qu’une restriction des aliments protidiques proportionnelle au degré de l’insuffisance excrétoire des reins est souvent nécessaire; cette restriction ne peut cependant s’abaisser au-dessous d’un apport quotidien minimal de 0,6 g/kg/j, soit environ 40 g de protides par jour chez l’adulte, sous peine d’entraîner des accidents de carence azotée, y compris une aggravation possible de la maladie rénale. La ration de sel est souvent conditionnée par la tension artérielle autant et plus que par l’insuffisance rénale: l’hypertension artérielle conduit à restreindre la ration de sodium, tandis qu’en l’absence d’hypertension artérielle un régime normalement salé est souvent possible (sauf le cas particulier des situations où existent des œdèmes, tel le syndrome néphrotique).
Le syndrome néphrotique entraîne la prescription d’un régime pauvre en sel, de médicaments diurétiques, de perfusions veineuses d’albumine humaine et, surtout, chaque fois que la biopsie rénale montre des altérations dont on sait aujourd’hui qu’elles entrent dans la liste des maladies améliorables par ce traitement, des dérivés de la cortisone, parfois complétés par des médicaments immunosuppresseurs.
Traitement de remplacement des fonctions rénales
On a déjà mentionné le bouleversement que les méthodes d’épuration extrarénale ont apporté aux possibilités d’action dans l’insuffisance rénale aiguë. Mais, aujourd’hui, l’urémie chronique parvenue au stade ultime où les reins ne sont plus capables d’assurer la vie peut, elle aussi, bénéficier d’un traitement salvateur, grâce aux techniques de dialyse et à la greffe rénale.
Les techniques de dialyse utilisent soit l’hémodialyse périodique, soit la dialyse péritonéale de suppléance.
L’hémodialyse périodique , ou usage répété, deux ou trois fois par semaine, du rein artificiel, s’est développée depuis 1960, date à laquelle Scribner, de Seattle, conçut pour la première fois un dispositif ingénieux permettant d’obtenir l’accès permanent et facile aux vaisseaux sanguins, nécessaire à la réalisation pratique de ce traitement. En une dizaine d’années à peine, ce mode de remplacement de la fonction rénale absente s’est répandu dans le monde entier et des milliers de malades sont ainsi maintenus en vie et en pleine activité par des séances régulières de dialyse par le rein artificiel, dans des centres spécialisés ou même à domicile.
La technique de l’hémodialyse repose sur la mise en présence, de part et d’autre d’une membrane de dialyse (fig. 5), du sang du malade et d’une solution de composition choisie. Le sang est prélevé à l’aide de dispositifs de canulation des vaisseaux de l’avant-bras, par l’intermédiaire d’une fistule artério-veineuse, chirurgicalement créée entre l’artère radiale et une veine de l’avant-bras (fig. 6). La veine se dilate sous l’afflux du sang artériel et permet des ponctions indéfiniment renouvelées à l’aide d’aiguilles de calibre approprié. Le liquide de dialyse est fabriqué par des générateurs munis de dispositifs de contrôle très précis, assurant la sécurité et l’automaticité de l’hémodialyse. Au total, la conduite du traitement exige de douze à dix-huit heures d’épuration par semaine, réparties en deux ou trois séances hebdomadaires. Il en résulte une servitude indiscutable, tenant à la longueur des horaires de dialyse, mais n’interdisant nullement, dans la pratique, le retour à une activité familiale et socio-professionnelle voisine de la normale.
De nombreux progrès sont venus améliorer les conditions de survie des malades ainsi traités. Ils tiennent, d’une part, à l’amélioration de la technologie, en particulier à l’augmentation de l’efficacité des membranes de dialyse aujourd’hui utilisées. Ils tiennent, d’autre part, aux progrès considérables qui ont été faits dans la connaissance du mécanisme de l’urémie et de ses complications, et des traitements préventifs qui peuvent être désormais opposés à nombre de ces manifestations. Il n’existe aucune limite théorique à la survie offerte par l’hémodialyse périodique. De fait, de nombreux malades sont traités depuis plus de trente ans par cette technique, et de nouveaux progrès sont espérés dans l’avenir. Tous tendent à la réduction de la durée des séances de dialyse, grâce à l’utilisation de membranes de dialyse améliorées, tout en sachant que des raisons physiologiques interdisent d’espérer abaisser cette durée au-dessous de trois heures par séance de dialyse.
La dialyse péritonéale de suppléance , qui avait été utilisée sous forme de dialyses intermittentes de très longue durée du fait de la faible efficacité des échanges à travers la séreuse péritonéale, connaît un regain de faveur sous la forme de dialyse péritonéale continue ambulatoire (D.P.C.A.), comme l’a proposée Oréopoulos à Toronto, en 1976. Cette technique, beaucoup plus simple que la précédente, consiste en l’introduction dans la cavité péritonéale, de trois à cinq fois par vingt-quatre heures, de deux litres de solution de dialyse stérile, préalablement tiédie, fournie sous forme de poches en matière plastique munies de leur tubulure. Cette technique se prête à l’utilisation par le malade lui-même à domicile.
Quant aux indications et aux résultats de la greffe rénale , on les trouvera développés à l’article TRANSPLANTATIONS D’ORGANES.
Ces deux traitements sont complémentaires: le plus souvent, une transplantation rénale ne peut être effectuée d’emblée et le délai d’attente nécessaire sera assuré par la pratique des hémodialyses périodiques. Dans certains cas, des malades ne sont pas en mesure, pour des raisons tenant à l’état anatomique de leur vessie ou à des raisons immunologiques, de bénéficier de l’espoir d’une transplantation rénale. Enfin, la transplantation rénale est déconseillée, habituellement, chez les malades âgés de plus de cinquante ans, car leur tolérance au traitement immunosuppresseur est moins bonne que celle des sujets plus jeunes. Ces patients relèvent alors d’un traitement définitif par l’hémodialyse périodique. Il est judicieux, dans ce cas, de les orienter vers un entraînement à la dialyse à domicile, de manière à leur assurer la plus grande autonomie possible.
rein [ rɛ̃ ] n. m.
• 1170 plur. « lombes »; lat. renes n. m. pl.
1 ♦ LES REINS : la partie inférieure du dos, au niveau des vertèbres lombaires. ⇒ lombes. Cambrure des reins. Reins cambrés. Une belle chute de reins. Une gibecière « lui battait sur les reins » (Barrès). — Donner un coup de reins, un violent effort des muscles de la région lombaire. — Douleur, maux de reins : douleur lombaire. Avoir mal aux reins. Tour de reins. ⇒ lumbago. — Loc. Avoir les reins solides, le dos robuste (pour porter); fig. être de taille à triompher d'une épreuve. « Le patron se savait les reins solides [...] sa fabrique fermée, il avait de quoi vivre » (Aragon). Avoir les reins souples. Casser les reins à qqn. Mettre à qqn l'épée dans les reins, le contraindre (moralement) à se hâter d'agir, le harceler. ⇒ éperonner, poursuivre.
♢ La taille. « la même corde autour des reins » (Hugo).
♢ Loc. bibl. Sonder les reins et les cœurs, l'inconscient, l'instinct, et les sentiments.
2 ♦ (1538; h. XIVe) Chacun des deux organes sécréteurs glandulaires, situés symétriquement dans les fosses lombaires et qui élaborent l'urine. Rein droit et rein gauche. Relatif aux reins. ⇒ néphrétique, rénal. Le rein est coiffé par la capsule surrénale. Bassinet, calices du rein. Tubes urinifères, glomérules du rein. ⇒aussi pyramide. L'urine sort du rein par l'uretère et pénètre dans la vessie. — Maladies du rein : calcul, gravelle, lithiase, pierre, néphrite, pyélite (⇒ néphrologie) . Rein flottant : ptose du rein. Ablation d'un rein : néphrectomie. Greffe du rein. — Rein artificiel : appareil permettant de suppléer à la fonction rénale déficiente (⇒ hémodialyse) . Il est sous rein artificiel.
♢ Les rognons sont les reins comestibles d'un animal.
3 ♦ (1491; du 1o) Archit. Partie d'une voûte comprise entre la tangente menée au sommet de l'extrados et les prolongements des piédroits.
● rein nom masculin (latin ren, renis) Organe pair placé dans l'abdomen à côté de la colonne vertébrale, qui forme l'urine à partir de la filtration du sang, élimine des déchets, participe à l'équilibre de l'eau et des minéraux dans l'organisme, et sécrète diverses substances (rénine, par exemple). Chacun des remplissages réalisés au-dessus de l'extrados d'une voûte pour supporter un plancher. ● rein (expressions) nom masculin (latin ren, renis) Cancer du rein, tumeur maligne du rein développée à partir du tissu rénal. Greffe de rein, transfert d'un des reins d'un sujet donneur sur un malade receveur dont les reins ne fonctionnent plus. Kyste du rein, cavité pathologique située dans le rein, de contenu fluide, limitée par une paroi. Rein artificiel, appareil épurant le sang de ses déchets à la place des reins en cas d'insuffisance rénale. Rein en éponge, affection congénitale caractérisée par une dilatation des tubes collecteurs des urines dans chaque rein (chaque néphron se termine par un tel tubule). Rein en fer à cheval, malformation caractérisée par une fusion des deux reins. Rein vide, espace non rempli au-dessus de l'extrados de voûtes non porteuses. Tour de rein, synonyme de lumbago.
rein
n. m.
d1./d Plur. Les reins: les lombes, la partie inférieure du dos. Avoir mal aux reins.
— Loc. fig. Avoir les reins solides: être assez puissant, assez prospère pour pouvoir surmonter d'éventuelles difficultés. Casser les reins à qqn, briser sa carrière.
|| Litt. Ceinture, taille. Se ceindre les reins d'un pagne.
d2./d (Sing.) Chacun des deux organes qui élaborent l'urine.
|| Rein artificiel: appareil qui assure l'épuration du sang en cas d'insuffisance rénale (V. dialyse).
Encycl. Physiol. - La totalité de la masse sanguine traversant le rein en quatre ou cinq minutes, 1 700 litres de sang passent chaque jour par l'appareil rénal. Les reins maintiennent l'équilibre du milieu intérieur en épurant le sang des substances toxiques et en compensant les "entrées" dans le milieu intérieur par des "sorties" (sécrétion d'urine), et ils participent au contrôle de la pression artérielle en sécrétant de la rénine.
⇒REIN, subst. masc.
A. — Gén. au sing.
1. ANAT. HUM. Chacun des deux organes sécrétant l'urine, placés de chaque côté de la colonne vertébrale sur la paroi abdominale postérieure au niveau des dernières vertèbres dorsales, mesurant en moyenne 12 cm de longueur et ayant une forme comparable à celle d'un haricot. Ablation, greffe du rein; calcul du rein. Ces deux grands symptômes urinaires qui se montrent dans la plupart des affections chirurgicales des reins, l'hématurie et la pyurie (Ce que la Fr. a apporté à la méd., 1946, p. 215):
• 1. Ce que l'estomac digéra parfaitement, le rein finit par ne plus pouvoir l'éliminer, et mon cousin, au lieu de vivre vieux avec une maladie d'estomac imaginaire qui le forçait à suivre un régime, mourut à quarante ans, l'estomac guéri mais le rein perdu.
PROUST, Guermantes 1, 1920, p. 291.
♦ Rein flottant. Synon. de néphroptose (s.v. néphro-).
— ANAT. ANIM.
♦ [Chez les animaux supérieurs] Organe de fonction et de forme identiques dont la grosseur varie avec celle de l'animal considéré. Rein lobulé. Dans le phoque, l'aorte abdominale envoie deux artères au rein gauche, tandis que le droit n'en reçoit qu'une (CUVIER, Anat. comp., t. 4, 1805, p. 256).
ALIM. Cet organe chez certains animaux (bovidés, porc, mouton...) en tant qu'il est comestible et commercialisé en boucherie ou en triperie. Synon. rognon. La chair des reins est excellente quand elle provient de jeunes herbivores, mauvaise quand elle est fournie par des animaux vieux ou carnivores; le rein de veau contient jusqu'à 22 grammes de substances azotées (MACAIGNE, Précis hyg., 1911, p. 217).
♦ [Chez les animaux inférieurs] Appareil excréteur ayant la même fonction. Chez les insectes, les reins sont des dépendances du tube digestif (QUILLET 1965).
2. MÉD. Rein artificiel. Appareil destiné à purifier le sang du patient par prélèvement au niveau d'une artère ou d'une veine, passage dans un dialyseur puis réintroduction dans une veine. Deux types d'indications justifient l'emploi du rein artificiel: les néphropathies aiguës et les néphropathies chroniques (Lar. Méd. t. 3 1972).
Rem. Les termes sav. en méd. et anat. concernant le rein sont constr. à partir des racines gr. néphro- et néphros à l'exception de rénogramme et rénographie formés à partir de la racine lat. réno- (s.v. néphro- vitalité).
B. — Au plur.
1. Région lombaire. Synon. lombes. Hier, je me suis fait arracher une de mes dernières dents, et aujourd'hui j'ai une grande douleur de reins, un lumbago (FLAUB., Corresp., 1879, p. 199). Boniface (...) partit à toutes jambes, retraversa le petit jardin, s'élança à travers la plaine, à travers les récoltes, courant à perdre haleine, secouant sa sacoche qui lui battait les reins (MAUPASS., Contes et nouv., t. 1, Crime père Bonif., 1884, p. 154).
SYNT. Avoir mal aux reins; souffrir des reins; se frotter les reins; se chauffer les reins au soleil; prendre qqn sous les reins; être nu jusqu'aux reins; avoir les reins brisés, rompus, en bouillie (fam.), engourdis; attraper, avoir un tour de reins (synon. lumbago).
a) Cette partie du corps en tant que réserve de force et de vigueur. Et voici que, de tout le pressoir énorme, aux assemblages chevillés, sous les tours saccadés, irrésistibles de la roue, maniée à grands efforts de reins, des voix sortaient et éclataient (PESQUIDOUX, Chez nous, 1923, p. 94). L'homme qui soulève des poids, c'est avec ses reins qu'il les soulève, c'est d'un déhanchement des reins qu'il étaye la force multipliée de ses bras (ARTAUD, Théâtre et son double, 1938, p. 161).
— P. anal. [Chez l'animal, en partic. les bovidés et les équidés] Chaque précipice [a] son sauteur. Le saumon franchit le sien avec les reins, la marmotte avec les pieds, l'écureuil volant avec les bras (BERN. DE ST-P., Harm. nat., 1814, p. 236). Les gros traîneurs de charrues [les chevaux] on les avait attachés dans les brancards des charrettes et ils retenaient à pleins reins des chargements de femmes et d'enfants (GIONO, Gd troupeau, 1931, p. 11).
— Loc. et expr.
♦ Tour de reins, coup de reins. Mouvement de la taille et des hanches pour produire un effort plus ou moins violent. D'un tour de reins, je m'étais dégagé, envoyant au hasard un solide coup de poing dans la direction de mon assaillant (BENOIT, Atlant., 1919, p. 178). Et maintenant (...) ajouta-t-il en se levant d'un vif coup de reins, « allons voir si le Pilote est de retour! » (MARTIN DU G., Thib., Été 14, 1936, p. 237).
♦ Avoir les reins solides, forts, absol. avoir des reins. Avoir une grande force, de la vigueur. À de tels chemins, il faut de telles voitures. Mais, au voyageur, il faut des reins solides (G. LEROUX, Roul. Tsar, 1912, p. 143):
• 2. Écoutez, reprit Madeleine, il y a encore assez de place sous la voiture pour qu'un homme s'y glisse et la soulève avec son dos. Rien qu'une demi-minute, et l'on tirera le pauvre homme. Y a-t-il ici quelqu'un qui ait des reins et du cœur? Cinq louis d'or à gagner!
HUGO, Misér., t. 1, 1862, p. 217.
Au fig. Être assez riche et/ou puissant pour supporter une épreuve, affronter l'adversité, entreprendre une chose difficile. Pour que le bonhomme Neuville lui ait confié de si gros intérêts, il faut que le jeune homme ait les reins solides (AUGIER, Beau mariage, 1859, p. 155). [Garnotelle] a senti, à son dernier envoi de Rome, qu'il n'avait pas assez de reins pour la grande peinture (GONCOURT, Man. Salomon, 1867, p. 204).
♦ Briser, casser les reins de qqn; se casser, se rompre les reins. Briser le dos, la colonne vertébrale de quelqu'un; se briser le dos. Lorsque le travail manquait à Rognes, elle se louait à Cloyes, portant des fardeaux à se rompre les reins (ZOLA, Terre, 1887, p. 169). Je montais lentement sans quoi il m'eût cassé impitoyablement les reins, je m'en rendis bien compte une fois ou deux alors que je semblai grimper trop vite (VIALAR, Faux fuyants, 1953, p. 196).
Au fig. Ruiner, briser la carrière, l'entreprise de quelqu'un. Ce sujet bourgeois m'abrutit (...). Ce sera un joli tour de force, je le sais, mais j'ai peur quelquefois de m'y casser les reins, ou, du moins, il me semble qu'ils faiblissent (FLAUB., Corresp., 1853, p. 223).
b) Cette partie du corps dans l'anatomie, la physionomie, la silhouette de quelqu'un.
 ) Le bassin et les hanches. Cambrure, chute des reins; un tortillement, un balancement, un mouvement des reins; des reins élégants; jouer des reins, se camper sur ses reins. Je restai seul à la forge avec mon nouveau compagnon, Simon Benerotte, un solide gaillard, la barbe rude et les reins massifs (ERCKM.-CHATR., Hist. paysan, t. 1, 1870, p. 391). Je m'étais assis dans l'espoir que vînt s'installer devant moi une belle personne de qui je pusse contempler la descente de reins (MONTHERL., Pte Inf. Castille, 1929, p. 597).
) Le bassin et les hanches. Cambrure, chute des reins; un tortillement, un balancement, un mouvement des reins; des reins élégants; jouer des reins, se camper sur ses reins. Je restai seul à la forge avec mon nouveau compagnon, Simon Benerotte, un solide gaillard, la barbe rude et les reins massifs (ERCKM.-CHATR., Hist. paysan, t. 1, 1870, p. 391). Je m'étais assis dans l'espoir que vînt s'installer devant moi une belle personne de qui je pusse contempler la descente de reins (MONTHERL., Pte Inf. Castille, 1929, p. 597). — P. métaph. La route est devenue comme une reine. Tout le long du nord-ouest un allongement de collines paysannes la suit avec maintenant des roches décharnées, des reins échinés par la pluie (GIONO, Eau vive, 1943, p. 146).
 ) La taille. Les généraux français, avec leur écharpe tricolore autour des reins, leurs grands chapeaux à cornes en travers de la tête, et leurs sabres traînants, se promenaient dans cette chambre (ERCKM.-CHATR., Ami Fritz, 1864, p. 180). Hauts sur jambes, efflanqués, la courte veste de laine brune aux reins, le béret sur les yeux, ils allaient en groupe (PESQUIDOUX, Chez nous, 1923, p. 85).
) La taille. Les généraux français, avec leur écharpe tricolore autour des reins, leurs grands chapeaux à cornes en travers de la tête, et leurs sabres traînants, se promenaient dans cette chambre (ERCKM.-CHATR., Ami Fritz, 1864, p. 180). Hauts sur jambes, efflanqués, la courte veste de laine brune aux reins, le béret sur les yeux, ils allaient en groupe (PESQUIDOUX, Chez nous, 1923, p. 85). ) Les fesses. Si jamais Morache nous disait: « Vous allez me baiser le gras des reins », on n'aurait rien à répondre, rien à foutre, qu'à l'aider à se déculotter (DORGELÈS, Croix de bois, 1919, p. 116).
) Les fesses. Si jamais Morache nous disait: « Vous allez me baiser le gras des reins », on n'aurait rien à répondre, rien à foutre, qu'à l'aider à se déculotter (DORGELÈS, Croix de bois, 1919, p. 116). ) Le dos.
) Le dos. — (Avoir +) subst. désignant une arme + dans les reins. Être menacé par une personne qui tient une arme dans votre dos. À la queue, le peloton formant l'escorte avait l'ordre de pousser les traînards, la baïonnette dans les reins (ZOLA, Débâcle, 1892, p. 471). Ils marchent pesamment, les bras en l'air, un canon de fusil dans les reins; quand ils sont tous contre le mur, dix fusils sont braqués sur eux (T'SERSTEVENS, Itinér. esp., 1963, p. 289).
♦ Au fig. Être acculé, pris au piège. J'ai tant sermonné Charpentier que l'imprimeur me pousse l'épée dans les reins; et je ne suis pas encore à la moitié! (FLAUB., Corresp., 1879, p. 297).
— [Pour marquer par l'attitude du corps, courbé en avant, l'humilité, la servilité, et, au fig., attitude morale de qqn qui plie, qui s'humilie devant qqn ou qqc.] Oui, Votre Seigneurie, répondit la vieille en s'inclinant avec cette souplesse de reins particulière au peuple italien (PONSON DU TERR., Rocambole, t. 1, 1859, p. 49). La pauvreté (...) oblige ceux qu'elle aime à lutter dans l'ombre avec elle et ils sortent un jour de son étreinte les tendons froissés, mais (...) les reins plus souples (A. FRANCE, Vie fleur, 1922, p. 557).
— En partic. Tour de(s) reins. Exercice de danse ou d'acrobatie qui consiste à renverser le corps en arrière de manière à provoquer une cambrure très exagérée du dos. Je faisais le pitre, des tours de passe-passe (...) des exercices d'acrobatie, le tour des reins ou le grand écart (CENDRARS, Bourlinguer, 1948, p. 179). Différents tours de reins. A) Tour de reins dégagé; B) tour de reins levé (BOURGAT, Techn. danse, 1959, p. 117).
c) Cette partie du corps en tant que siège des passions et des impulsions.
 ) [P. réf. à la loc. biblique] Sonder les reins et les cœurs. Les passions inconscientes par opposition aux activités conscientes conduites par le cœur. La Providence a des voies bien cachées, elle sonde les reins et les cœurs (BALZAC, Goriot, 1835, p. 208). [Jahvé] est le juge des peuples et il sonde les reins et les cœurs; il rend justice selon le droit, parce qu'il est juste (Théol. cath. t. 4, 1 1920, p. 973).
) [P. réf. à la loc. biblique] Sonder les reins et les cœurs. Les passions inconscientes par opposition aux activités conscientes conduites par le cœur. La Providence a des voies bien cachées, elle sonde les reins et les cœurs (BALZAC, Goriot, 1835, p. 208). [Jahvé] est le juge des peuples et il sonde les reins et les cœurs; il rend justice selon le droit, parce qu'il est juste (Théol. cath. t. 4, 1 1920, p. 973). ) Lieu de manifestations physiques d'impressions ou de sentiments. Mathieu sentit qu'un frisson de joie allait naître au creux de ses reins; il eut honte, il se dit avec application: nous avons perdu la guerre (SARTRE, Mort ds âme, 1949, p. 94).
) Lieu de manifestations physiques d'impressions ou de sentiments. Mathieu sentit qu'un frisson de joie allait naître au creux de ses reins; il eut honte, il se dit avec application: nous avons perdu la guerre (SARTRE, Mort ds âme, 1949, p. 94). ) Symbole de la puissance sexuelle ou procréatrice de l'homme. Cette rousse audacieuse (...) avait l'air de porter sur sa tête tous les incendies qu'elle allumait dans les reins juvéniles des écoles (BLOY, Désesp., 1886, p. 68). Puissent les reins de tes hommes se tarir comme ceux de l'eunuque, et tes femmes, hurlantes d'amour et de stérilité, appeler, sur le pas de leur porte, une semence étrangère (TOULET, Mariage Don Quichotte, 1902, p. 254).
) Symbole de la puissance sexuelle ou procréatrice de l'homme. Cette rousse audacieuse (...) avait l'air de porter sur sa tête tous les incendies qu'elle allumait dans les reins juvéniles des écoles (BLOY, Désesp., 1886, p. 68). Puissent les reins de tes hommes se tarir comme ceux de l'eunuque, et tes femmes, hurlantes d'amour et de stérilité, appeler, sur le pas de leur porte, une semence étrangère (TOULET, Mariage Don Quichotte, 1902, p. 254). 2. P. anal.
a) ARCHIT. Partie d'une voûte ou d'un cintre comprise entre la ligne de courbe et le prolongement de la ligne de portée. [Sur le tympan de l'arc] se donne carrière le génie de la décoration (...) tantôt ce sont des figures humaines qui se couchent sur les reins de l'arc, et vont s'appuyer à l'agrafe; tantôt ce sont des allégories (Ch. BLANC, Gramm. arts dessin, 1876, p. 241).
b) SYLVIC. Bordure d'un bois ou d'une forêt. On (...) trouve presque toujours [le putier] aux reins des forêts dans les terrains humides, et sur le bord des aunaies (BAUDRILLART, Nouv. manuel forest., t. 1, 1808, p. 229).
Prononc. et Orth.:[ ]. Att. ds Ac. dep. 1694. Étymol. et Hist. 1. 1re moit. XIIe s. subst. masc. plur. « région lombaire » spéc. dans la Bible « siège de la vie affective et des impulsions inconscientes » (Psautier Cambridge, éd. Fr. Michel, VII, 9); 1531 être faible de reins pour + inf. « être incapable de » (MAROT, Epitre, XXV, Au Roy, éd. C. A. Mayer, p. 176, 103: Et si sentez que soys foible de reins Pour vous payer); 1640 (OUDIN Curiositez: il n'a pas les reins assez forts .i. il n'a pas assez de force ou de pouuoir); 2. 1328 anat. rains (Plantaire, éd. M. A. Savoie, f ° 9 v °, p. 36, 13); 3. p. anal. 1491 archit. faux rains (Béthune, ap. La Fons, Gloss. ms., Bibl. Amiens ds GDF. Compl.); 1557 plur. reins (Chambre des comptes de Paris, éd. A.-M. de Boislisle, p. 69, note 1, f ° LXI). Du lat. class. renes, -um « reins » et « lombes », développé en lat. chrét. aux sens de « reins, lombes (siège de la vie affective) » et « dos, reins », v. BLAISE Lat. chrét., dont le sing. ren, renis est inusité. Fréq. abs. littér.:1 754. Fréq. rel. littér.:XIXe s.: a) 1 679, b) 2 937; XXe s.: a) 3 442, b) 2 382. Bbg. WARTBURG (W. von). Glanures étymol. R. Ling. rom. 1960, t. 24, pp. 287-288.
]. Att. ds Ac. dep. 1694. Étymol. et Hist. 1. 1re moit. XIIe s. subst. masc. plur. « région lombaire » spéc. dans la Bible « siège de la vie affective et des impulsions inconscientes » (Psautier Cambridge, éd. Fr. Michel, VII, 9); 1531 être faible de reins pour + inf. « être incapable de » (MAROT, Epitre, XXV, Au Roy, éd. C. A. Mayer, p. 176, 103: Et si sentez que soys foible de reins Pour vous payer); 1640 (OUDIN Curiositez: il n'a pas les reins assez forts .i. il n'a pas assez de force ou de pouuoir); 2. 1328 anat. rains (Plantaire, éd. M. A. Savoie, f ° 9 v °, p. 36, 13); 3. p. anal. 1491 archit. faux rains (Béthune, ap. La Fons, Gloss. ms., Bibl. Amiens ds GDF. Compl.); 1557 plur. reins (Chambre des comptes de Paris, éd. A.-M. de Boislisle, p. 69, note 1, f ° LXI). Du lat. class. renes, -um « reins » et « lombes », développé en lat. chrét. aux sens de « reins, lombes (siège de la vie affective) » et « dos, reins », v. BLAISE Lat. chrét., dont le sing. ren, renis est inusité. Fréq. abs. littér.:1 754. Fréq. rel. littér.:XIXe s.: a) 1 679, b) 2 937; XXe s.: a) 3 442, b) 2 382. Bbg. WARTBURG (W. von). Glanures étymol. R. Ling. rom. 1960, t. 24, pp. 287-288.
 ]. Att. ds Ac. dep. 1694. Étymol. et Hist. 1. 1re moit. XIIe s. subst. masc. plur. « région lombaire » spéc. dans la Bible « siège de la vie affective et des impulsions inconscientes » (Psautier Cambridge, éd. Fr. Michel, VII, 9); 1531 être faible de reins pour + inf. « être incapable de » (MAROT, Epitre, XXV, Au Roy, éd. C. A. Mayer, p. 176, 103: Et si sentez que soys foible de reins Pour vous payer); 1640 (OUDIN Curiositez: il n'a pas les reins assez forts .i. il n'a pas assez de force ou de pouuoir); 2. 1328 anat. rains (Plantaire, éd. M. A. Savoie, f ° 9 v °, p. 36, 13); 3. p. anal. 1491 archit. faux rains (Béthune, ap. La Fons, Gloss. ms., Bibl. Amiens ds GDF. Compl.); 1557 plur. reins (Chambre des comptes de Paris, éd. A.-M. de Boislisle, p. 69, note 1, f ° LXI). Du lat. class. renes, -um « reins » et « lombes », développé en lat. chrét. aux sens de « reins, lombes (siège de la vie affective) » et « dos, reins », v. BLAISE Lat. chrét., dont le sing. ren, renis est inusité. Fréq. abs. littér.:1 754. Fréq. rel. littér.:XIXe s.: a) 1 679, b) 2 937; XXe s.: a) 3 442, b) 2 382. Bbg. WARTBURG (W. von). Glanures étymol. R. Ling. rom. 1960, t. 24, pp. 287-288.
]. Att. ds Ac. dep. 1694. Étymol. et Hist. 1. 1re moit. XIIe s. subst. masc. plur. « région lombaire » spéc. dans la Bible « siège de la vie affective et des impulsions inconscientes » (Psautier Cambridge, éd. Fr. Michel, VII, 9); 1531 être faible de reins pour + inf. « être incapable de » (MAROT, Epitre, XXV, Au Roy, éd. C. A. Mayer, p. 176, 103: Et si sentez que soys foible de reins Pour vous payer); 1640 (OUDIN Curiositez: il n'a pas les reins assez forts .i. il n'a pas assez de force ou de pouuoir); 2. 1328 anat. rains (Plantaire, éd. M. A. Savoie, f ° 9 v °, p. 36, 13); 3. p. anal. 1491 archit. faux rains (Béthune, ap. La Fons, Gloss. ms., Bibl. Amiens ds GDF. Compl.); 1557 plur. reins (Chambre des comptes de Paris, éd. A.-M. de Boislisle, p. 69, note 1, f ° LXI). Du lat. class. renes, -um « reins » et « lombes », développé en lat. chrét. aux sens de « reins, lombes (siège de la vie affective) » et « dos, reins », v. BLAISE Lat. chrét., dont le sing. ren, renis est inusité. Fréq. abs. littér.:1 754. Fréq. rel. littér.:XIXe s.: a) 1 679, b) 2 937; XXe s.: a) 3 442, b) 2 382. Bbg. WARTBURG (W. von). Glanures étymol. R. Ling. rom. 1960, t. 24, pp. 287-288.
rein [ʀɛ̃] n. m.
ÉTYM. 1538; rain, XIVe; au plur., « lombes », v. 1120; le rein « les lombes », mil. XIIIe; lat. renes, inus. au sing. ren.
❖
1 Les reins : la partie inférieure du dos, au niveau des vertèbres lombaires. ⇒ Lombes. || Cambrure (cit. 1 et 2) des reins. ⇒ Ensellure. || Reins cambrés (→ Incliner, cit. 6). || La chute (cit. 16) des reins. || Les reins cassés, pliés… d'un vieillard (→ Fosse, cit. 7). — Une gibecière (cit. 1) lui battait les reins. — ☑ Loc. Mettre l'épée dans les reins à qqn (→ Nettoyer, cit. 15). — Coup de reins : violent effort des muscles de la région lombaire (→ Hisser, cit. 7; incommode, cit. 5; poids, cit. 4). — Douleur, maux de reins : douleur lombaire (→ État, cit. 6). || Se sentir les reins brisés (→ Fatigue, cit. 10). ⇒ Éreinté. — ☑ Loc. (1870). Tour de reins. ⇒ Lumbago. || Attraper un tour de reins. — (Animaux). || Chien court de reins (→ Levretté, cit.). ⇒ aussi 2. Râble.
1 Et, comme l'odalisque d'Ingres,
De ses reins cambrant les rondeurs (…)
Th. Gautier, Émaux et Camées, « Poème de la femme ».
2 Leurs reins féconds sont pleins d'étincelles magiques (…)
Baudelaire, les Fleurs du mal, « Spleen et idéal », LXVI, Les chats.
♦ La taille. || Avoir une corde autour des reins (→ Même, cit. 5). || Sangler ses reins d'une corde. — ☑ Loc. bibl. Ceindre (cit. 2 et 3) ses reins.
♦ La force des reins, les reins : la force du dos, de la colonne vertébrale et des muscles de la région lombaire. || Être faible des reins (→ Enlever, cit. 1).
♦ ☑ Loc. Avoir les reins solides : être assez puissant, assez riche pour ne pas souffrir d'un danger, pour sortir vainqueur d'une épreuve, d'une lutte… || Cette banque a les reins solides. — ☑ Casser les reins à qqn (au fig.; déb. XXe), le ruiner, briser sa carrière. || Il s'est cassé les reins dans cette entreprise.
3 Le patron se savait les reins solides. Premièrement, sa fabrique fermée, il avait de quoi vivre, de l'argent placé.
Aragon, les Cloches de Bâle, II, XI.
♦ ☑ Loc. bibl. Scruter, sonder les reins et les cœurs (cit. 118), l'inconscient, l'instinct et les sentiments.
REM. || « Les reins sont le siège des passions et des impulsions inconscientes, le cœur celui de l'activité consciente (…) cœur et reins sont souvent associés (…) pour désigner l'ensemble des puissances intérieures de l'homme » (Bible de Jérusalem, Sages, I, 1, 6, note h).
2 (XVIe; attestation isolée, XIVe). L'un des deux organes sécréteurs, glandulaires, situés dans les fosses lombaires et qui élaborent l'urine. ⇒ Excrétion. — REM. La partie supérieure des reins est en rapport avec la région thoracique et ne correspond pas à la région des lombes, communément appelée reins (→ ci-dessus, 1.). — Relatif au rein. ⇒ Néphrétique, rénal. || Qui a la forme d'un rein. ⇒ Réniforme. || Hile, sinus du rein. || Capsule fibroadipeuse entourant le rein (loge fibreuse du rein). || Le rein est coiffé par la capsule surrénale. — Zone corticale, médullaire du rein; lobes du rein. || Tubes urinifères, glomérules du rein… ⇒ aussi Pyramide (de Malpighi); papille. || Appareil excréteur du rein. ⇒ Bassinet, 2. calice (cit. 4), uretère, vessie; urée, urine. || Artères, veines du rein. || Les vaisseaux émulgents portent le sang aux reins. || Le rein expulse les déchets provenant du métabolisme azoté, régularise la pression osmotique et l'équilibre acido-basique de l'organisme. — Maladies du rein. ⇒ 2. Calcul, gravelle (cit. 3), lithiase, pierre; endonéphrite, néphrite, néphrocèle, pyélite. || Cancer, tuberculose; kyste, lésion du rein. — Chir. || Ablation d'un rein. ⇒ Néphrectomie (→ Illusionner, cit. 4). — (1964). || Rein artificiel : appareil permettant l'épuration extra-rénale par hémodialyse.
4 C'est en passant dans les reins qu'il (le sang) achève de se purifier. Les reins séparent du sang les produits qui doivent être éliminés et règlent la quantité des sels qui sont indispensables au plasma pour que sa tension osmotique reste constante.
Alexis Carrel, l'Homme, cet inconnu, III, VII.
♦ Rein flottant, rein mobile : ptose rénale.
♦ Appareils excréteurs correspondant aux reins, chez les animaux inférieurs. ⇒ Néphridie. || Reins « primordiaux » (⇒ Pronéphros) et reins « primitifs » (⇒ Mésonéphros) des embryons des vertébrés. || Reins lobulés de certains mammifères. — Reins comestibles de certains animaux. ⇒ Rognon.
3 (1491; par anal. du sens 1.). Archit. Partie d'une voûte comprise entre la tangente menée au sommet de l'extrados et les prolongements des pieds-droits.
❖
DÉR. Reinté.
HOM. Rain.
Encyclopédie Universelle. 2012.