AMÉRICIUM
L’américium (symbole Am) est un élément artificiel qui fait partie d’une série d’éléments lourds découverts depuis 1940, les transuraniens . Comme tous ces éléments, il possède de nombreux isotopes, tous radioactifs. Son numéro atomique, 95, le place, dans la classification périodique, après l’uranium, le neptunium et le plutonium, avec lesquels il présente de nombreuses analogies.
Élément purement synthétique, l’américium n’existe probablement pas à l’état naturel: il se forme principalement dans les réacteurs nucléaires lors de l’irradiation du plutonium 239 par les neutrons.
Découverte
Albert Ghiorso, Ralph A. James, Leon O. Morgan et Glenn T. Seaborg identifièrent à la fin de l’année 1944, au Metallurgical Laboratory de l’université de Chicago, l’isotope de masse 241 de l’élément 95, qu’ils nommèrent américium, par analogie avec l’europium, son homologue selon une classification impliquant un parallélisme de propriétés entre deux séries d’éléments, les lanthanides et les «actinides» [cf. TRANSURANIENS]. Quelques mois plus tard, le premier composé pur de 241Am fut isolé dans le même laboratoire par Burris B. Cunningham. Six ans après, en 1951, E. F. Westrum et L. R. Eyring préparèrent le métal à partir de quelques centaines de microgrammes de trifluorure d’américium 241. Des centaines de grammes d’américium prennent naissance dans des réacteurs à flux de neutrons très intense. Cette production a pour but de permettre l’élaboration de futures cibles pour la synthèse d’éléments transuraniens plus lourds.
Isotopes utilisés. Dangers biologiques
Parmi la vingtaine d’isotopes actuellement connus de l’américium, deux émetteurs alpha – 241Am et 243Am – jouent un rôle important dans la détermination des propriétés chimiques de l’élément, car ils bénéficient d’une durée de vie relativement élevée. Seul disponible pendant longtemps en raison de sa plus grande facilité de formation, 241Am permit d’établir, à l’échelle du microgramme, la majeure partie des connaissances actuelles sur les propriétés physiques et chimiques de l’élément. Mais la manipulation de cet isotope est dangereuse et requiert des précautions particulières; en effet, l’activité spécifique du rayonnement alpha est très élevée (7,5 . 109 désintégrations par minute et par milligramme). En cas d’introduction accidentelle dans l’organisme, l’ostéotropisme de cet élément, joint à une toxicité chimique importante font que la dose de tolérance pour l’homme serait de 0,05 microcurie au maximum, soit 0,015 microgramme de 241Am pour la totalité du corps. D’autre part, il existe aussi un «risque externe», car le rayonnement alpha est associé à une émission gamma (59 keV). L’américium 243, de demi-vie plus grande (7 950 ans à comparer à 458 ans pour 241Am), donc d’activité spécifique moindre, serait plus approprié pour les études à l’échelle macroscopique, mais sa production est encore faible. Bien que les isotopes d’américium soient encore stables vis-à-vis de la fission spontanée, on a produit des isomères de durée de vie très courte par rapport à ce mode de désintégration (isomères de fission spontanée de quelques fractions de seconde).
Physico-chimie
L’américium métallique a une couleur blanc argenté qui se ternit lentement dans l’air, même sec; il semble plus ductile et malléable que l’uranium et le neptunium. Sa densité à 20 0C est de 13,67 et son point de fusion voisin de 850 0C. De caractère fortement électropositif (le potentiel normal d’oxydoréduction du couple Am(III)-Am(0) est de 漣 2,36 V), ce métal n’est obtenu que par l’action, à haute température, de réducteurs puissants sur des sels anhydres. On réduit, par exemple, du trifluorure d’américium à 1 000 0C par de la vapeur de baryum. L’américium s’obtient sous deux variétés allotropiques: une structure hexagonale compacte à température ordinaire se transforme en forme cubique à faces centrées vers 600 0C.
Cet élément a de nombreux états de valence : 0, III, IV, V et VI. Mais, en solution aqueuse, le plus stable est l’état d’oxydation III, dont le comportement chimique est proche de celui de l’actinium, des lanthanides et des autres transuraniens trivalents (curides).
Les solutions d’américium III sont préparées par dissolution dans un acide du métal, de son amalgame ou de l’hydroxyde.
Elles ont une couleur rose ou jaune suivant leur concentration et présentent un spectre d’absorption dans le visible très caractéristique (raie principale vers 500 nm) qui permet leur identification et, dans certaines conditions, leur dosage. Les ions Am3+ manifestent une tendance marquée à former des complexes avec les anions des acides minéraux et organiques. L’action d’oxydants énergiques, tels que l’ozone, les persulfates et les ions argentiques, permet d’obtenir les états de valence supérieurs de l’américium, qui existent sous la forme d’ions oxygénés: AmO2+ et Am22+. Leur réduction est aisée et s’effectue spontanément sous l’effet du rayonnement émis par les isotopes utilisés (241Am ou 243Am). L’américium pentavalent se dismute en donnant Am(VI) et Am(III); ce phénomène, très complexe, s’effectue probablement par l’intermédiaire d’ions Am4+; on connaît aussi quelques combinaisons de l’américium tétravalent: AmO2, Am4 et Am(OH)4.
Sous ses autres états d’oxydation, l’américium forme également divers composés : fluorures AmF3 et Am4, trichlorure et sesquioxyde Am23, hydroxydes de Am(III) ou de Am(VI), carbonate double d’américium pentavalent, acétate double d’américium VI et de sodium... et même hydrure AmH2 et monoxyde AmO présentant un caractère métallique.
Production
L’américium s’accumule dans les combustibles nucléaires, où il peut être récupéré au cours de leur traitement chimique. Il se trouve mélangé à de nombreux autres éléments: le plutonium 239 ou l’uranium (c’est-à-dire le combustible) existent en quantités généralement importantes; on trouve aussi les produits de fission et d’autres éléments transuraniens formés par divers processus nucléaires. La stabilité de l’américium III est très nettement supérieure à celle des ions trivalents de l’uranium, du neptunium ou du plutonium, qui peuvent être sélectivement oxydés. Cette propriété est utilisée pour isoler Am(III) par des méthodes de séparation telles que l’échange d’ions et l’extraction par des solvants organiques, méthodes qui font intervenir des propriétés caractéristiques des états de valence. Plus délicate est la séparation entre l’américium et des éléments tels que les lanthanides et le curium, qui présentent avec Am(III) une grande similitude de comportement chimique.
La proportion relative des divers isotopes de l’américium formé dans les réacteurs dépend de l’importance du flux neutronique et du temps d’irradiation. Ainsi, à partir du plutonium 239, l’américium 241 prend naissance à l’issue d’une séquence de réactions nucléaires qui peut être schématisée de la manière suivante:

(deux captures successives de neutron sont suivies d’une décroissance 廓-). Mais 241Am formé, irradié à son tour par les neutrons lents, peut donner naissance à certains isotopes de nombre de masse plus élevé:
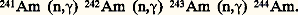
Le bombardement par des particules chargées accélérées (deutons, hélions ou ions lourds) de cibles appropriées permet également de synthétiser l’américium [cf. TRANSURANIENS].
Les isotopes les plus lourds (247 à 255) de l’élément ont été détectés dans les débris d’explosions thermonucléaires. Ils seraient formés par émissions bêta successives d’isotopes très lourds de l’uranium, eux-mêmes produits à la suite de captures multiples de neutrons par 238U. Cet accroissement de masse est rendu possible par une densité très élevée de neutrons au moment de l’explosion.
américium [ amerisjɔm ] n. m. ♦ Chim. Élément transuranien artificiel de la série des actinides (Am; no at. 95; m. at. [de l'isotope de plus longue période] 243), obtenu depuis 1944 dans des réacteurs nucléaires.
● américium nom masculin (de America, par analogie avec l'europium) Élément chimique artificiel de numéro atomique 95, qui suit le plutonium dans la série des corps transuraniens. (Symb. Am.)
américium
n. m. CHIM élément radioactif artificiel (symbole Am) appartenant à la famille des actinides, de numéro atomique Z = 95.
⇒AMÉRICIUM, subst. masc.
,,Métal transuranien de la série des Actinides, obtenu à partir de l'uranium en le bombardant avec des particules  accélérées.`` (GRAND. 1962) :
accélérées.`` (GRAND. 1962) :
 accélérées.`` (GRAND. 1962) :
accélérées.`` (GRAND. 1962) :• On possède maintenant la liste des 92 premiers éléments chimiques dont le nombre atomique va de 1 pour l'hydrogène à 92 pour l'uranium. La liste s'arrête à 92, mais il existe pourtant des éléments transuraniens, inconnus dans la nature, mais qui ont été produits artificiellement, allant de 93 à 98 : neptunium, plutonium, americium, curium, berkelium, californium.
R. FURON, L'Évolution de la géologie au XXe siècle, Revue des sciences, t. 63, 1956, p. 35.
Rem. Électron. 1963-64 dit ,,americum ou américium``.
Prononc. :[ ] (cf. Pt Lar. 1968).
] (cf. Pt Lar. 1968).
 ] (cf. Pt Lar. 1968).
] (cf. Pt Lar. 1968).Étymol. ET HIST. — 1953 chim. (Lar. 20e Suppl. Américium).
Élément obtenu par Glenn Theodore Seaborg en 1945, dont le nom est formé sur America p. anal. avec le nom de l'élément homologue europium.
BBG. — CHARLES 1960. — DUVAL 1959. — Électron. 1963-64 (s.v. américum). — GALIANA Déc. sc. 1968. — GRAND. 1962. — MUSSET-LLORET 1964. — Nucl. 1964. — PAMART (P.). De l'alchimie à la chimie. Vie Lang. 1969, n° 204, p. 141. — Sc. 1962. — UV.-CHAPMAN 1956.
américium [ameʀisjɔm] n. m.
ÉTYM. 1948; angl. americium, 1945, Seaborg; formé sur America par anal. avec le nom de l'élément homologue europium.
❖
♦ Chim. Élément transuranien artificiel (symb. Am; no at. 95; dens. 13,67), obtenu depuis 1944 dans des réacteurs nucléaires.
Encyclopédie Universelle. 2012.