SÉLÉNIUM
Le sélénium a été découvert en 1817 par Jöns Jacob Berzelius dans les boues des chambres de plomb utilisées pour la préparation de l’acide sulfurique. C’est un élément rare, présent très souvent à l’état de traces dans les sulfures naturels où il se substitue au soufre. Les espèces minéralogiques qui en contiennent des quantités notables – dont les principales sont ees séléniures de cuivre, d’argent, de thallium, de plomb et de mercure – sont trop peu abondantes pour constituer des minerais. Aussi le sélénium n’est qu’un sous-produit de l’affinage électrolytique du cuivre. Le sélénium est un non-métal de symbole Se, de numéro atomique Z = 34 et de masse atomique 78,96. Six isotopes existent à l’état naturel; leurs nombres de masse sont très voisins de 74, 76, 77, 78, 80 et 82. Leurs abondances sont respectivement de 0,87 p. 100, 9,02 p. 100, 7,58 p. 100, 23,52 p. 100, 49,82 p. 100 et 9,19 p. 100. De plus, une vingtaine d’isotopes radioactifs ont été préparés par réactions nucléaires. L’isotope 79, émetteur 廓- de période 6,5 憐 104 années, semblerait aussi exister à l’état naturel.
De structure électronique à l’état fondamental 1 s 2; 2 s 2, 2 p 6; 3 s 2, 3 p 6, 3 d 10; 4 s 2, 4 p 4, il est situé dans la colonne VI b de la classification périodique, entre le soufre et le tellure. Il présente donc des analogies marquées avec ces éléments, surtout avec le tellure. Ses premier, deuxième et troisième potentiels d’ionisation sont de 9,75 eV, 21,3 eV et 33,9 eV, et son électronégativité est égale à 2,48 (échelle de Allred-Rochow). Les rayons atomique et covalent sont respectivement de 0,140 nm et 0,117 nm. Se2- a un rayon de 0,198 nm, Se4+ de 0,050 nm et Se6+ de 0,042 nm.
Les composés du sélénium sont généralement covalents. Dans quelques complexes anioniques, les électrons 4 s sont inertes, mais dans la plupart des composés les orbitales 4 s et 4 p se combinent linéairement pour participer aux liaisons.
Allotropie et propriétés physiques
Le sélénium se présente à l’état solide sous deux formes désordonnées: amorphe et vitreuse, et sous trois formes cristallisées: la variété trigonale grise et les deux variétés monocliniques 見 et 廓.
Le sélénium amorphe , rouge, est obtenu par précipitation à partir d’une solution aqueuse, par exemple par réduction d’une solution d’acide sélénieux par l’hydrogène, le zinc, l’anhydride sulfureux, etc., ou par condensation de la vapeur sur une paroi froide. Il se transforme en sélénium gris à une température mal définie entre 110 et 180 0C. De densité 4,26, il est doué de propriétés photoconductrices.
Le sélénium vitreux , noir, se forme par refroidissement brutal du sélénium liquide. Il semble qu’il existe dans cette phase un ordre à courte distance: certains atomes Se auraient deux proches voisins situés à 0,230 nm et huit autres à 0,376 nm. S’il est maintenu au-dessus de 70 0C, le sélénium vitreux se transforme en sélénium gris, forme commerciale habituelle (densité 4,28).
Les variétés monocliniques 見 et 廓, rouges, sont constituées par des cycles Se8 non coplanaires, apparemment analogues d Se-Se \# 0,234 nm, Se 漣Se 漣Se \# 105,70). Elles se distinguent essentiellement par le mode d’association de ces cycles et par les paramètres de maille (pour la forme 見: a = 0,905 nm, b = 0,907 nm, c = 1,161 nm, 廓 = 90,770 et pour la forme 廓: a = 1,285 nm, b = 0,807 nm, c = 0,931 nm, 廓 = 93,130). Elles cristallisent toutes deux par évaporation d’une solution de sélénium dans le sulfure de carbone; une vitesse d’évaporation lente donne la forme 見, une vitesse rapide la forme 廓. Ces deux variétés, de densité voisine de 4,46, métastables, se transforment en sélénium gris à une température mal définie un peu supérieure à 100 0C.
Le sélénium gris , parfois improprement appelé sélénium métallique, cristallise dans le système trigonal (groupe spatial P3121). Les atomes Se régulièrement espacés se répartissent sur des chaînes hélicoïdales dont les axes sont parallèles à l’arête c de la maille (a = 0,436 62 nm, c = 0,493 56 nm). Ces axes se projettent sur un plan perpendiculaire à l’arête c suivant les nœuds d’un réseau hexagonal plan. Les projections des atomes d’une même chaîne forment un triangle équilatéral. Chaque atome Se est entouré de deux premiers voisins à 0,237 3 nm situés sur la même chaîne, l’angle de liaison étant de 103,10, et de quatre seconds voisins à 0,343 6 nm appartenant à des chaînes adjacentes. Des monocristaux de plusieurs centimètres cubes ont été obtenus, notamment à partir d’un bain de sélénium maintenu en surfusion de 0,3 à 0,5 0C en dessous du point de fusion. Le sélénium trigonal constitue la variété thermodynamiquement stable. Au-dessus de 100-110 0C, toutes les autres variétés se transforment en sélénium trigonal. Il peut être obtenu directement par refroidissement lent du sélénium liquide ou par condensation des vapeurs de sélénium sur une paroi à 20 0C environ. De densité 4,81, il fond à 217 0C et donne un liquide rouge brun qui bout à 685 0C en émettant une vapeur rouge foncé. Le sélénium trigonal est un semiconducteur dont les caractéristiques sont encore mal interprétées. Un modèle fondé sur la notion de barrière interne le présente comme un intermédiaire entre les semiconducteurs parfaits et les semiconducteurs désordonnés. Il permet d’expliquer sa photoconductivité importante et les variations de la conductivité en fonction de la température, de la tension appliquée et de la fréquence du courant. Signalons enfin la possibilité d’obtenir du sélénium colloïdal par diverses méthodes.
Propriétés chimiques
Le sélénium est capable de réagir avec de nombreux éléments pour donner des composés présentant une grande analogie avec les composés correspondants du soufre.
Le séléniure d’hydrogène rappelle le sulfure d’hydrogène. Il peut être obtenu par action d’un acide dilué, comme l’acide chlorhydrique, sur un séléniure métallique ou par chauffage à 225 0C d’un mélange de sélénium et d’hydroxyde de magnésium anhydre. Gazeux (ébullition à 42 0C), il est très toxique. Instable, il se décompose, lentement dès la température ordinaire, rapidement à 300 0C. Il brûle dans l’air. Sa solution dans l’eau se comporte comme un diacide faible. Les séléniures ont des caractéristiques proches de celles des sulfures.
Les composés halogénés du sélénium sont moins nombreux que ceux du soufre. Ils appartiennent à quatre types: Se2X2(X = Cl, Br), SeX2(X = Cl, Br), SeX4 (X = F, Cl, Br) et SeX6 (X = F). Les iodures ne sont pas connus. Les halogénures SeX2 n’ont pu être isolés: ils ne se manifestent que dans des mélanges, à l’état de vapeur, entre 200 et 500 0C. Les autres halogénures peuvent être obtenus par synthèse directe.
L’affinité du sélénium pour l’oxygène est plus faible que celle du soufre. Seuls deux oxydes sont bien connus: SeO2 et Se3. Le dioxyde se forme par combustion du sélénium à l’air. Sa structure à l’état solide, identique à celle de S2, est constituée de chaînes infinies en zigzag: 漣O 漣Se(O) 漣 O 漣Se(O) 漣... 漣Se(O) 漣. Il se sublime à 315 0C sous la pression normale et fond vers 340 0C en tube scellé. Ses propriétés oxydantes, quoique peu marquées, le sont plus que celles de S2. Ainsi Se2 est réduit par S2. Le dioxyde de sélénium se dissout facilement dans l’eau pour donner l’acide sélénieux; la solution obtenue laisse déposer par concentration à la température ambiante des cristaux orthorhombiques de H2Se3, ce qui distingue le sélénium du soufre. Il suffit d’une légère élévation de température pour que ces cristaux perdent de l’eau et redonnent Se2. L’acide sélénieux est plus faible que l’acide sulfureux. Il lui correspond divers sels: les sélénites et les hydrogénosélénites.
L’acide sélénique H2Se4 est obtenu par action d’un agent oxydant puissant (fluor, chlore, brome, ion permanganate, oxydation anodique, etc.) sur Se, Se2, H2Se3 en présence d’eau. En plus des phases H2Se4 et H2Se27, les hydrates H2Se4, x H2O (x = 1, 2, 4, 6) ont été isolés. L’acide sélénique est un diacide fort, très hygroscopique, encore plus oxydant que H2S4. Ses sels, les séléniates et les hydrogénoséléniates, sont les homologues des sulfates et des hydrogénosulfates. Sa déshydratation s’accompagne généralement de perte d’oxygène; aussi le trioxyde Se3 ne peut être obtenu qu’avec difficulté par action de S3 sur K2Se4 ou par action d’une décharge électrique sur une suspension de sélénium dans une atmosphère raréfiée d’oxygène. Solide blanc à la température ordinaire (fusion à 118 0C), déliquescent, il semble exister sous deux formes cristallines.
Le diséléniure de carbone CSe2 est obtenu par action, vers 550-600 0C, du dichlorométhane CH2Cl2 sur le sélénium fondu. Liquide jaune or à la température ambiante (ébullition à 125 0C), il a une structure linéaire dans laquelle les atomes Se peuvent être considérés comme hybridés diagonalement. Les composés OCSe et SCSe sont de même nature.
Il existe aussi de très nombreux composés organo-séléniés comme les sélénols RSeH, les séléniures RSeR , les sélénoxides RR SeO, les sélénones RR Se2, les halogénures d’alkyl ou d’aryl sélénium RSeXn , les sélénocyanates RSeCN et aussi les séléniures hétérocycliques tel le sélénophène . Certains présentent de l’intérêt pour leur conductivité électrique.
Sources et utilisations. Toxicité
Le sélénium a constitué un sous-produit de l’acide sulfurique tant que celui-ci a été obtenu par le procédé des chambres de plomb. Maintenant, il provient essentiellement des boues anodiques obtenues lors de l’affinage électrolytique du cuivre qui contiennent aussi Te, Cu, Pb, Au, Ag, etc. Ces boues peuvent être soumises à un traitement oxydant par voie sèche (grillage en milieu alcalin) ou par voie humide (action de H2S4 concentré bouillant). Le dioxyde de sélénium distille. Recueilli dans un système de Cottrell, il est ensuite réduit par action de S2. Un autre procédé consiste à transformer Se et Te en sélénite et tellurite alcalins par action de la soude à chaud. Après mise en solution aqueuse on précipite successivement le dioxyde de tellure hydraté, par neutralisation, à l’aide d’acide sulfurique, puis le sélénium, par décomposition de l’acide sélénieux restant au moyen de S2.
Les propriétés électriques du sélénium, notamment l’accroissement de sa conductivité quand il est exposé à la lumière, sont mises à profit dans les cellules photoélectriques photoconductrices, dans les photopiles (effet photoélectrique), les redresseurs de courant alternatif (redresseur fer-sélénium), la xérographie pour la reproduction de documents et les plaques au sélénium utilisées en radiographie. Il est aussi utilisé comme colorant rouge des verres et des céramiques et comme élément d’appoint dans certains aciers, pour diminuer la sensibilité à la corrosion et augmenter la résistance aux chocs thermiques. Enfin, il pourrait entrer dans la composition d’écrans destinés à recueillir les images fournies par des sources d’infrarouge.
Le sélénium solide est relativement inoffensif. En revanche, les vapeurs de sélénium et le séléniure d’hydrogène sont fortement toxiques. Les sélénites et les séléniates solubles ainsi que les dérivés organiques doivent entre autres être manipulés avec précaution. La dose maximale de sélénium ou de composés du sélénium généralement tolérée dans l’air est de 0,1 mg/m3.
sélénium [ selenjɔm ] n. m.
• 1817; de selênê « Lune », à cause de sa ressemblance avec le tellure
♦ Chim. Élément atomique (Se; no at. 34; m. at. 78,96) du même groupe que l'oxygène, le soufre et le tellure, qui existe sous diverses formes allotropiques. Les cristaux de sélénium sont photoconducteurs.
● sélénium nom masculin Non-métal de la colonne VI B du tableau périodique, présentant des analogies avec le soufre. (Élément de symbole Se.) Numéro atomique : 34 Masse atomique : 78,96 Point de fusion : 217 °C Masse volumique : 4,79 g°cm3 Oligoélément indispensable à l'organisme, aux propriétés antioxydantes.
sélénium
n. m. CHIM élément (symbole Se) de numéro atomique Z = 34.
— Corps simple (Se) dont la variété métallique possède deux propriétés intéressantes: sa photoconductivité et son pouvoir photoélectrique.
⇒SÉLÉNIUM, subst. masc.
CHIM. Élément de symbole Se, de poids atomique 78,96, de numéro atomique 34, ayant diverses analogies avec le tellure et le soufre, se présentant sous plusieurs formes allotropiques et trouvant de nombreuses applications: coloration en orange, en rouge de certaines matières, vulcanisation, fabrication de cellules photoélectriques, par exemple. Cellule au sélénium. Conductibilité photo-électrique. — Depuis la découverte de l'action de la lumière sur la résistance du sélénium, on a montré que le même phénomène se produit avec un grand nombre de substances très diverses (M. CURIE, Luminescence, 1934, p. 65). Le sélénium est capable de réagir avec de nombreux éléments pour donner des composés présentant une grande analogie avec les composés correspondants du soufre (Encyclop. univ. t. 14 1972, p. 851, col. 3).
Prononc. et Orth.:[ ]. Att. ds Ac. dep. 1878. Étymol. et Hist. 1818 (BERZÉLIUS, lettre du 9 févr. ds Ann. chim. et phys., t. 7, 1817, p. 203: pour rappeler les rapports de cette [substance nouvelle] avec le tellure, je l'ai nommée sélénium). Mot formé par le chimiste suédois J.-J. Berzélius sur le gr.
]. Att. ds Ac. dep. 1878. Étymol. et Hist. 1818 (BERZÉLIUS, lettre du 9 févr. ds Ann. chim. et phys., t. 7, 1817, p. 203: pour rappeler les rapports de cette [substance nouvelle] avec le tellure, je l'ai nommée sélénium). Mot formé par le chimiste suédois J.-J. Berzélius sur le gr.  « la Lune », en raison de l'anal. des propriétés de ce corps avec le tellure (lat. sc. tellurium), dont le n. est dér. du lat. tellus, telluris « la Terre ».
« la Lune », en raison de l'anal. des propriétés de ce corps avec le tellure (lat. sc. tellurium), dont le n. est dér. du lat. tellus, telluris « la Terre ».
 ]. Att. ds Ac. dep. 1878. Étymol. et Hist. 1818 (BERZÉLIUS, lettre du 9 févr. ds Ann. chim. et phys., t. 7, 1817, p. 203: pour rappeler les rapports de cette [substance nouvelle] avec le tellure, je l'ai nommée sélénium). Mot formé par le chimiste suédois J.-J. Berzélius sur le gr.
]. Att. ds Ac. dep. 1878. Étymol. et Hist. 1818 (BERZÉLIUS, lettre du 9 févr. ds Ann. chim. et phys., t. 7, 1817, p. 203: pour rappeler les rapports de cette [substance nouvelle] avec le tellure, je l'ai nommée sélénium). Mot formé par le chimiste suédois J.-J. Berzélius sur le gr.  « la Lune », en raison de l'anal. des propriétés de ce corps avec le tellure (lat. sc. tellurium), dont le n. est dér. du lat. tellus, telluris « la Terre ».
« la Lune », en raison de l'anal. des propriétés de ce corps avec le tellure (lat. sc. tellurium), dont le n. est dér. du lat. tellus, telluris « la Terre ».DÉR. 1. Séléniate, subst. masc., chim. Sel de l'acide sélénique. La forme ordinaire des cristaux de sulfate de nickel, de sulfate de zinc, etc., est un prisme rhomboïdal droit (...). C'est donc une forme limite, et elle peut passer par une faible variation dans les angles des pans au prisme droit à base carrée. C'est, en effet, l'autre forme des cristaux de sulfate de nickel et de séléniate de zinc (PASTEUR ds Ann. chim. et phys., t. 23, 1848, p. 285). — [selenjat]. — 1re attest. 1818 (BERZÉLIUS, op. cit., p. 204); de sélénium, suff. -ate. 2. Sélénié, -ée, adj., chim. ,,Combiné ou mélangé au sélénium`` (DUVAL 1959). Hydrogène sélénié. Le palladium sélénié du Hartz (ÉLIE DE BEAUMONT ds B. Sté géol. Fr., t. 4, 1847, p. 40). — [selenje]. — 1re attest. 1818 (BERZÉLIUS, op. cit., t. 9, p. 231); de sélénium, suff. -é. 3. Sélénieux, adj. masc., chim. Acide, anhydride sélénieux. Acide (H2SeO3), anhydride (SeO2) dérivés du sélénium. L'acide sélénieux est très soluble dans l'eau (Nouv. traité de chim. min., Paris, Masson, t. 13, 1961, p. 1823). V. sélénolite, s.v. sélén(i)- ex. de Nouv. traité de chim. min. — [selenjø]. Att. ds Ac. dep. 1878. — 1re attest. 1827 (E. MITSCHERLICH ds Ann. chim. et phys., t. 36, p. 101); de sélénium, suff. -eux. 4. Sélénique, adj. masc., chim. Acide, anhydride sélénique. Acide (H2SeO4), anhydride (SeO3) dérivés du sélénium. L'anhydride sélénique SeO3, dont l'existence a longtemps été considérée comme douteuse, a été obtenu, mélangé à l'anhydride sélénieux, par Rheinboldt, Hessel et Schwenzer, en 1930 (Nouv. traité de chim. min., Paris, Masson, t. 13, 1961, p. 1809). L'acide sélénique H2SeO4 est obtenu par action d'un agent oxydant puissant (...) sur Se, SeO2, H2SeO3 en présence d'eau (Encyclop. univ. t. 14 1972, p. 852, col. 1). — [selenik]. Att. ds Ac. 1935. — 1res attest. 1818 « (acide) sélénieux » (BERZÉLIUS, op. cit., t. 7, p. 204), 1827 « (acide) sélénique » (E. MITSCHERLICH, loc. cit.); de sélénium, suff. -ique. 5. Séléniure, subst. masc., chim. Combinaison du sélénium avec un ou plusieurs corps simples; sel de l'acide sélénhydrique. Séléniure métallique. L'hydrogène sélénié [donne] dans une solution du métal précieux, du séléniure d'or (CUMENGE, ROBELLAZ, Or ds nature, 1898, p. 12). — [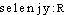 ]. — 1re attest. 1818 « combinaison du sélénium avec un corps simple » (BERZÉLIUS, op. cit., t. 7, p. 203); de sélénium, suff. -ure2.
]. — 1re attest. 1818 « combinaison du sélénium avec un corps simple » (BERZÉLIUS, op. cit., t. 7, p. 203); de sélénium, suff. -ure2.
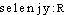 ]. — 1re attest. 1818 « combinaison du sélénium avec un corps simple » (BERZÉLIUS, op. cit., t. 7, p. 203); de sélénium, suff. -ure2.
]. — 1re attest. 1818 « combinaison du sélénium avec un corps simple » (BERZÉLIUS, op. cit., t. 7, p. 203); de sélénium, suff. -ure2.BBG. — DUB. Dér. 1962, p. 83 (s.v. sélénieux).
sélénium [selenjɔm] n. m.
ÉTYM. 1817; du grec selênê « Lune », à cause de sa ressemblance avec le tellure, tiré de tellus nom lat. de la Terre, dont la Lune est le satellite.
❖
♦ Chim. Corps simple (symb. Se; poids at. 78,96; no at. 34; dens. 4,8; température de fusion 217 °C), qui existe sous diverses formes allotropiques. || On trouve le sélénium à l'état de séléniure dans la nature. || Sélénium amorphe, vitreux, cristallisé, rouge ou gris… (ce dernier a une conductibilité électrique variable lorsqu'il est exposé à la lumière et on l'emploie dans certaines cellules photo-électriques).
♦ (1904, Rev. gén. des sc., no 1, p. 5). || Pile à sélénium.
❖
DÉR. Sélénié, sélénieux, sélénique, 1. sélénite, séléniure.
COMP. Sélénhydrique, sélénifère, sélénio-.
Encyclopédie Universelle. 2012.