PHOTOSYNTHÈSE
Le terme «photosynthèse» signifie littéralement: synthèse réalisée à l’aide de l’énergie lumineuse. Bien que, en ce sens, différentes réactions synthétiques puissent avoir lieu indépendamment des êtres vivants, il est d’usage de ne désigner par ce mot que la capacité des végétaux chlorophylliens à assimiler le dioxyde de carbone ou gaz carbonique, à la lumière, avec formation de substances organiques. On l’appelait autrefois assimilation chlorophyllienne.
Plus précisément, la photosynthèse comprend l’utilisation de l’énergie lumineuse pour la réduction du dioxyde de carbone par l’eau, donneur d’hydrogène (ou d’électrons + protons), avec synthèse de glucides et libération d’oxygène. Cette réaction est réalisée dans des organites intracellulaires spécialisés, les chloroplastes, porteurs de pigments photorécepteurs, tels que les chlorophylles, les caroténoïdes.
La réduction du dioxyde de carbone par l’eau (ou, chez les bactéries chlorophylliennes, par d’autres substances telles que l’acide sulfhydrique, l’hydrogène ou bien un composé organique, un acétate par exemple) nécessite un apport d’énergie assez élevé. L’originalité du mécanisme est d’utiliser des photons et de les convertir en énergie chimique qui se retrouve dans l’énergie de liaison des atomes de carbone et d’hydrogène dans les glucides formés. Huit photons au moins sont nécessaires pour permettre la réduction d’une molécule de dioxyde de carbone par l’eau.
Deux types de réactions participent à cette réduction. Les unes, purement photochimiques , se déroulent entre les photons absorbés et les molécules de pigments. Les autres, réactions sombres , concernent la biochimie du carbone; elles se présentent schématiquement comme l’inverse du mécanisme respiratoire consommateur de glucides et d’oxygène avec formation de dioxyde de carbone et d’eau. La liaison entre ces deux types de réactions est réalisée par des transporteurs d’électrons (+ protons) appartenant aux nucléotides phosphates, et par l’adénosine-triphosphate, ou ATP, que l’on retrouve dans toutes les réactions bioénergétiques (cf. tableau).
1. Les étapes de la découverte
Le dégagement d’oxygène par les plantes vertes fut découvert par le pasteur physicien et philosophe anglais J. Priestley en 1772, quelques années avant que Lavoisier ne démontre que le dioxyde de carbone libéré par la respiration animale, ou par la combustion d’une chandelle, est formé de carbone et d’oxygène. En 1779, le Hollandais J. Ingen Housz découvre que ce dégagement n’a lieu qu’à la lumière; J. Senebier à Genève, en 1782, prouve la nécessité du dioxyde de carbone et, en 1804, N. T de Saussure, de Genève également, démontre que l’eau participe à la réaction.
En 1845, trois années après avoir énoncé le principe de la conservation de l’énergie, le physicien allemand R. Mayer discerne l’aspect fondamental du phénomène: «Les plantes prennent une force, la lumière, et engendrent une force, l’énergie chimique.»
Vingt ans après, l’accumulation d’amidon dans des feuilles éclairées est découverte, puis, à partir de 1880, les premiers spectres de lumière active sont tracés par C. Timiriazev, en Russie, et T. W. Engelmann, en Allemagne, reconnaît la photosynthèse des algues rouges et la photoréduction du gaz carbonique réalisée par quelques bactéries.
Au début du XXe siècle, on introduit la distinction entre réactions photochimiques , résultant de l’absorption de la lumière par les pigments, et réactions sombres , catalysées par des enzymes. À la même époque, on reconnaît le caractère quantique des phénomènes photochimiques; la loi d’Einstein stipule que toute transformation photochimique élémentaire exige l’absorption d’un quantum de lumière (photon) par une des molécules prenant part à cette transformation. Pour être efficace photochimiquement, la lumière doit être absorbée. La photosynthèse n’échappe pas à cette loi: son spectre d’action est à très peu près identique au spectre d’absorption des pigments photosynthétiques (essentiellement les chlorophylles) (fig. 1). Les radiations photosynthétiquement actives sont comprises entre 400 et 700 nm pour les végétaux verts, elles s’étendent jusqu’à 890 nm pour les bactéries photosynthétiques.
Contrairement aux réactions photochimiques, les réactions sombres (ou encore thermiques) sont accélérées par une élévation de température. Celles de la photosynthèse présentent beaucoup d’analogie avec celles du métabolisme général et de la respiration en particulier. Les réactions sombres se déroulent spontanément, avec libération d’énergie libre (sens exergonique). L’originalité de la photosynthèse est de les coupler aux réactions photochimiques, transformant l’énergie des photons en énergie chimiquement utilisable, pour réaliser un processus par lui-même globalement endergonique:

La réduction d’une molécule de dioxyde de carbone et simultanément l’oxydation de deux molécules d’eau donnent lieu à la formation d’un chaînon glucidique (CHOH) et à la libération d’une molécule d’oxygène. Ce processus nécessite au minimum l’utilisation de 8 einsteins (ou moles de photons), soit l’équivalent de 1380 kJ/mole. Le rendement de la photosynthèse est donc au mieux de 30 p. 100 environ.
Après la Seconde Guerre mondiale, les recherches en photosynthèse ont connu un essor considérable. Dans une première période, elles ont été marquées par l’élucidation, grâce à l’emploi des isotopes radioactifs, des nombreuses étapes sombres de l’intégration du carbone. La période qui lui a succédé a vu un très grand développement des méthodologies biophysiques (spectroscopie, cinétique), des études structurales par microscopie électronique notamment et des méthodes de plus en plus élaborées d’obtention de fractions subcellulaires actives (séparations diverses, électrophorèse, etc.). Chacune de ces approches concerne certains aspects seulement de l’appareil photosynthétique, mais l’ensemble converge vers une vision de plus en plus cohérente de la façon dont les structures supramoléculaires de l’appareil photosynthétique assurent l’ensemble des fonctions élémentaires permettant la conversion photosynthétique de l’énergie lumineuse (fig. 2).
2. L’appareil photosynthétique
Dans les feuilles vertes des plantes, dans les algues, la photosynthèse est réalisée par des organites spécialisés: les chloroplastes. Ils possèdent toujours une enveloppe formée de deux membranes: une externe perforée et une interne dotée de perméabilité sélective.
On y reconnaît la présence d’une structure fondamentale, la lamelle, remarquablement constante dans son architecture moléculaire générale. Il s’agit d’une bicouche lipidique (7 nm environ d’épaisseur), dans laquelle sont ancrées des macromolécules lipoprotéiques ou des complexes protéiques oligomériques. La fluidité des lipides membranaires (composés principalement de phospholipides et de galactolipides) autorise une certaine liberté de mouvement latéral de ces complexes. Toutes les molécules fonctionnellement associées aux étapes primaires de la photosynthèse sont intégrées soit au sein de la membrane (plastoquinones), soit comme protéines membranaires (cytochromes), soit liées de façon non covalente à celles-ci (chlorophylle des «antennes» et des «centres»). Mais certaines protéines (métallo-protéines telles la plastocyanine (Cu) ou la ferrédoxine (Fe)) s’associent de façon non permanente à certains sites de la membrane. Les plus gros complexes membranaires sont à la fois visibles en microscopie électronique et isolables après destruction ménagée de la membrane elle-même, de sorte qu’une localisation et une distribution assez précise de ces particules dans le plan de la membrane et selon sa normale a pu être abordée.
Chez les eucaryotes photosynthétiques (tous les végétaux chlorophylliens), il existe deux autres niveaux d’organisation englobant l’organisation supramacromoléculaire considérée ci-dessus. D’une part, les lamelles forment au sein du chloroplaste un réseau de vésicules (thylakoïdes) qui définissent deux phases sans communication immédiate: l’espace stromatique et l’espace intrathylakoïdal (ou lumen). À la polarité stroma-lumen ainsi définie correspond une organisation transversale (normale au plan membranaire) des complexes et composants membranaires, qui est de la plus haute importance pour l’énergétique de la conversion (cf. fig. 7). D’autre part, les lamelles peuvent s’accoler par endroits pour former des empilements de disques (granums, visibles en microscopie photonique) qui restent en relation de continuité avec des lamelles non accolées dispersées dans le stroma (fig. 3). On pense que cette disposition – fréquente mais non générale – représente une adaptation pour une répartition optimale de l’énergie lumineuse dans l’appareil.
Il est relativement aisé de séparer, après broyage du tissu foliaire, des fragments de chloroplastes capables à la lumière de dégager de l’oxygène et de réduire certains accepteurs d’électrons (par exemple le ferricyanure et de nombreux colorants). Cette réaction de Hill, du nom du biochimiste anglais qui l’a découverte, permet de démontrer que c’est au sein des structures thylakoïdales que s’effectue l’intégralité de la conversion au sens énergétique. En effet, ces fragments de membranes isolés sont capables de réduire le NADP (nicotinamide dinucléotide phosphate) et de phosphoryler l’ADP (adénosine diphosphate), à partir de quoi l’intégration du carbone en glucides peut s’effectuer de façon enzymatique spontanée.
On sait aller beaucoup plus loin dans la fragmentation de l’appareil en blocs élémentaires fonctionnels, notamment grâce à une attaque ménagée des membranes par des détersifs. Les centres réactionnels bactériens – où s’effectue l’acte photochimique de la conversion – donnent un bon exemple de cette démarche. On a pu déterminer la composition minimale d’un complexe, nécessaire à sa fonction: 3 sous-unités polypeptidiques, 4 molécules de bactériochlorophylle, 2 molécules de bactériophéophytine (macrocycle de chlorophylle privé de Mg), 1 molécule de caroténoïde, 2 molécules d’ubiquinone et 1 atome de fer. D’autres blocs fonctionnels sont, de nos jours encore, difficiles à extraire et à purifier (stœchiométrie variable) ou perdent une partie de leur activité au cours de l’isolement. Mais le démontage de la micromachine photosynthétique découvre une remarquable unité d’architecture moléculaire – preuve évidente d’une parenté phylogénique – et nous apprend que la structure de ces complexes, c’est-à-dire la disposition géométrique de ses parties, tout autant que leur nature biochimique, détermine spécifiquement leurs fonctions.
La structure granaire – dominante chez les végétaux supérieurs – a longtemps posé un problème d’interprétation. À quoi sert-elle? De nombreuses recherches ont été consacrées à ce problème. On s’est aperçu finalement que cette structure n’était pas statique, mais relativement mobile: sous l’influence de multiples facteurs (par exemple les ions Mg++ dans le stroma), les lamelles peuvent s’accoler ou se séparer réversiblement; parallèlement, on assiste à une migration des complexes membranaires qui peuvent se rassembler ou se disperser. Un des résultats inattendus de ces recherches en un sens contredit le schéma en «Z», pourtant si solidement établi (cf. fig. 5). Celui-ci, en effet, suggère naturellement qu’il doit exister dans la membrane une entité morphologique correspondant à la «chaîne photosynthétique» et constituée des deux principaux complexes: système II + système I. Or, si cette chaîne est bien une réalité sur le plan fonctionnel, son existence morphologique est extrêmement fluctuante. Ainsi, on a démontré, en les isolant, que les disques granaires ne comportent que des complexes système II et que tous les complexes système I (plus une minorité de système II) se rassemblent dans les lamelles dispersées dans le stroma. Il faut évidemment que des transporteurs mobiles – c’est le cas des plastoquinones – puissent établir une communication entre ces deux sortes d’édifices lamellaires. Cette singulière complication doit jouer un rôle, pense-t-on, dans l’adaptation de l’appareil photosynthétique au régime lumineux.
3. Les mécanismes primaires
L’unité photosynthétique: antenne et centre
On doit à deux chercheurs américains (R. Emerson et W. Arnold) la notion d’unité photosynthétique qui a joué un rôle fondamental dans la manière dont se comprend la relation structure-fonction dans l’appareil photosynthétique. Leurs travaux dans les années 1930-1940 ont révélé que, sous l’effet d’éclairs brefs et saturants (quelques microsecondes, quelques 10 size=1漣2 joule/cm2), l’acte photochimique élémentaire n’impliquait pas moins de 600 molécules de chlorophylle. Par ailleurs, on savait qu’au contraire, en faible lumière, l’absorption de tout photon se traduit par un acte photochimique élémentaire, avec un rendement quantique proche de l’unité. Le concept d’unité photosynthétique devait résoudre ce paradoxe. La chlorophylle remplit deux rôles essentiels: comme convertisseur photochimique dans les centres et comme collecteur de lumière dans les antennes. En fait, à chaque chlorophylle-centre sont associées quelques centaines de molécules de chlorophylle-antenne, en sorte que tout photon absorbé par l’une d’entre elles est transmis presque sans perte par transfert de résonance au centre où s’effectue la conversion. Cette disposition est compatible avec un excellent rendement en faible lumière. En revanche, au cours d’un éclair bref et saturant, chaque centre est activé, mais ne peut fonctionner qu’une fois, car le temps total de conversion – nécessaire pour qu’un centre, après avoir été excité, soit de nouveau capable d’être activé – est beaucoup plus long (environ 10 size=1漣4 s) que la durée d’un éclair. Tout se passe donc comme si une petite fraction seulement de la chlorophylle (1/600) était active dans ces conditions. L’inverse de ce rapport définit précisément la «taille» de l’unité photosynthétique.
Par analogie avec la photochimie non biologique, on pouvait s’attendre à ce que l’acte de conversion implique un phénomène d’oxydoréduction. Un ensemble de résultats expérimentaux, pour lesquels la spectroscopie par éclairs a joué un grand rôle, a imposé la notion que la conversion photochimique consiste en une séparation de charges entre un donneur primaire P et un accepteur primaire A selon les deux étapes:

P est la chlorophylle-centre; c’est un dimère de chlorophylle (ou de bactériochlorophylle); P 列 est son état excité (singulet). P fonctionne donc à la fois comme piège pour l’excitation lumineuse et comme donneur d’électron. A est une phéophytine (ou une chlorophylle). Ce schéma est général et se vérifie chez tous les organismes photosynthétiques. La conversion photochimique consiste donc à transformer l’énergie d’un photon en la différence de potentiel d’oxydoréduction existant entre les couples P+/P et A/A size=1漣. Le rendement énergétique de cette opération est excellent (de l’ordre de 60 p. 100). Quant à son rendement quantique (paire de charges séparées/photon absorbé), il est très proche de l’unité.
Les facteurs de cette remarquable performance ne sont pas définitivement élucidés. Du moins, deux propriétés de l’ensemble centre-antenne permettent-elles de la comprendre. D’une part, la vitesse des deux étapes ci-dessus est notablement plus grande (1011 s size=1漣1) que celle de la désactivation spontanée de l’excitation dans l’antenne (de 107 à 108 s size=1漣1) [fig. 4]. D’autre part, la recombinaison des charges, qui dissiperait l’énergie emmagasinée dans l’état P+A size=1漣 (en redonnant l’état PA) n’a qu’une infime probabilité de se produire. Mais, pour parfaite qu’elle soit, la conversion photochimique ne va pas sans pertes qui, même très faibles, constituent de précieux indicateurs sur l’état et le fonctionnement des centres et des antennes. Ces pertes se manifestent en effet par une fluorescence et une luminescence de la chlorophylle, dont les propriétés spectroscopiques et surtout cinétiques ont puissamment contribué à établir la validité du schéma de conversion.
Les deux systèmes photochimiques et le schéma en «Z»
Le bilan de la photosynthèse chez les plantes supérieures, c’est-à-dire simultanément l’oxydation d’une molécule d’eau et la réduction d’une molécule de dioxyde de carbone, implique la mobilisation de 4 électrons (et de 4 protons, soit de 4 atomes d’hydrogène). L’exigence quantique de la photosynthèse (8 h 益 / 2 ou C2) indique donc que 2 photons sont nécessaires pour transférer 1 électron. La signification de ce facteur 2 ne fut bien comprise qu’à partir des années 1957-1960 lorsque R. Emerson, étudiant le spectre d’action de la photosynthèse, montra que les radiations absorbées vers 690 nm et au-delà sont peu efficaces, à moins qu’elles ne soient supplémentées par des radiations de plus courtes longueurs d’onde. On ne tarda pas à comprendre que chez les végétaux supérieurs la photosynthèse est un processus biphotonique mettant en jeu deux sortes d’ensembles antennes-centre dont les spectres d’absorption sont légèrement décalés (en particulier dans le rouge lointain). L’explication du facteur 2 était donc que 2 photoréactions devaient opérer en série pour porter chaque électron du potentiel de 2/H2O jusqu’au potentiel de C2/(CHOH).
Ce schéma en série, plus connu sous le nom de schéma en «Z» (fig. 5), s’est trouvé conforté par un corps très important de résultats, particulièrement d’ordre cinétique. Mais la preuve sans doute la plus éloquente de sa validité est donnée par la possibilité d’isoler après fragmentation de la membrane deux sortes de subparticules possédant séparément chacune des activités photochimiques postulées. Chaque photoréaction, ainsi que les transporteurs directement associés, a reçu le nom de photosystème.
Convenant d’orienter les flèches dans le sens du transfert des électrons, on voit que le photosystème II extrait les électrons de l’eau (à + 0,8 volt) et les porte à un potentiel réducteur assez bas (face=F0019 漣 0,2 volt), mais encore insuffisant pour la réduction du C2. L’électron, d’abord capté par une phéophytine, se trouve stabilisé sur une plastoquinone spéciale, Q, puis transmis par l’intermédiaire d’une seconde plastoquinone, B (mobile), au «pool» principal des plastoquinones, PQ. La communication des électrons au photosystème I passe par un complexe à cytochromes (b 6 et f ) contenant également une protéine à fer et soufre (centre de Rieske) et par un transporteur mobile, la plastocyanine (PC, une protéine à Cu). Le déplacement des potentiels où opère le système I dans le sens réducteur résoud la difficulté énergétique évoquée ci-dessus: l’électron se trouve porté, à l’issue du deuxième acte photochimique, à un potentiel suffisamment réducteur (face=F0019 漣 1,0 volt) pour réduire facilement le NADP. Comme pour le photosystème II, plusieurs accepteurs associés au centre: A1, A2, etc., de la famille des ferrédoxines (Fd), stabilisent l’électron avant son transfert au NADP via une enzyme, la Fd-NADP oxydoréductase. Des protons sont également mis en jeu parallèlement au transfert des électrons: ils sont libérés aux étapes d’oxydation de H2O et de PQH2 et inversement, fixés à celles de réduction de PQ et NADP. Le schéma montre enfin qu’un transfert cyclique d’électrons peut avoir lieu, dans certaines circonstances, autour du système I. Le schéma en «Z» est commun à tous les organismes photosynthétiques oxygéniques. Par contre, les bactéries photosynthétiques, incapables d’oxyder l’eau, s’adressent à des donneurs d’hydrogène plus faciles à oxyder (composés du soufre, substrats organiques) et leur appareil ne comporte qu’un seul photosystème.
Une région qui est encore mal connue du système II concerne l’oxydation de l’eau. On sait seulement qu’elle se produit de façon séquentielle et cyclique en accumulant 4 équivalents oxydants capables de décomposer 2 molécules d’eau tout en libérant 1 molécule d’oxygène. C’est ce qu’ont élégamment démontré les expériences du Français P. Joliot et de l’Américain B. Kok (fig. 6).
La théorie de Mitchell
Le schéma en «Z» exprime de manière compacte la connexion mécanistique des transporteurs de la chaîne photosynthétique les uns aux autres. Il est remarquable qu’il reflète assez fidèlement l’organisation macromoléculaire de la membrane du thylakoïde, principalement dans le sens transversal (fig. 7). C’est ainsi que l’axe de la séparation de charges dans les deux photosystèmes est normal au plan membranaire; son sens est tel qu’elle tend à «projeter» l’électron à l’extérieur du thylakoïde. Deux conséquences en résultent. En premier lieu, la séparation des charges dans les deux photosystèmes crée un champ électrique transmembranaire. Comme l’a montré l’Allemand H. T. Witt, ce champ est assez fort (105 volt / cm) pour influencer par électrochromisme les pigments photosynthétiques, qui subissent des variations spectrales (par exemple à 515 nm) faibles, mais bien détectables. Notons que, à l’instar d’un condensateur, une certaine énergie se trouve ainsi momentanément stockée dans le diélectrique de la membrane. En second lieu, cette énergie est utilisée pour accélérer la fixation de protons sur la face externe du thylakoïde et leur libération dans sa phase interne (lumen). Comme la membrane est très peu perméable aux ions et qu’elle délimite un volume fermé, elle maintient donc entre ses deux faces un gradient de pH. L’énergie électrostatique est ainsi transformée en une nouvelle forme de stockage: l’énergie chimiosmotique du gradient de pH. C’est en réfléchissant à la signification de la compartimentation chez les mitochondries et les chloroplastes, qui permet une accumulation d’énergie sous forme chimiosmotique, que l’Anglais P. Mitchell (prix Nobel 1978) a pu proposer la théorie chimiosmotique [cf. BIOÉNERGÉTIQUE]. Celle-ci fournit notamment une explication cohérente de la photophosphorylation chez les chloroplastes. La membrane du thylakoïde porte en effet dans son épaisseur et sur sa face externe un complexe enzymatique, l’ATP-synthétase (CF0 et C1 sur la fig. 7), capable de canaliser les protons en excès dans la phase interne et d’utiliser l’énergie du gradient de pH pour synthétiser des molécules d’ATP. En définitive, celui-ci, relâché, ainsi que le NADPH2 dans la phase stromatique y seront les vecteurs d’énergie et d’électrons + protons suffisants pour l’intégration du carbone catalysée par les enzymes du cycle de Calvin (cf. chap. 4).
4. Les réactions sombres: la réduction du dioxyde de carbone
Les réactions sombres de la photosynthèse, (ou réactions thermiques, en raison de leur sensibilité à la température) sont maintenant bien connues grâce à la conjonction de méthodes et de techniques développées pendant et après la Seconde Guerre mondiale: utilisation d’isotopes traceurs, en particulier du radiocarbone 14 découvert en 1940, et analyse chimique par chromatographie.
Après avoir offert du 14C2 à une plante, il devient possible de suivre les différentes étapes de sa fixation dans les molécules organiques et de sa réduction. Les molécules nouvelles, grâce à leur composition isotopique, se distinguent des molécules de même nature chimique qui préexistaient dans les tissus, avant l’offre. Aujourd’hui, la séparation des différents métabolites est relativement simple, car la mesure de la radioactivité acquise après l’intégration du 14C est rapide et très sensible. La figure 8 illustre les résultats obtenus. Comme le 14C ne perd la moitié de sa radioactivité qu’en 5 000 ans environ, on peut le considérer comme un outil stable à notre échelle.
On doit à l’équipe de chercheurs de l’université de Berkeley dirigée par M. Calvin (prix Nobel de chimie, 1961) le développement des recherches sur ce sujet, depuis 1946. Chez les végétaux dits C3 (cf. chap. 5), le premier composé formé, l’acide phosphoglycérique , comporte 3 atomes de carbone. Il contient la quasi-totalité du radiocarbone du gaz carbonique fixé après quelques secondes, en présence de lumière. Il est formé par la fixation du dioxyde de carbone sur un glucide à 5 atomes de carbone, le ribulosebisphosphate. Cette fixation (5 C + 1 C) engendre 2 molécules d’acide phosphoglycérique (3 C 憐 2). Ensuite apparaît un glucide, également tricarboné: l’aldéhyde phosphoglycérique , produit de la réduction du corps précédent. Cette réduction est l’étape énergétique la plus importante des réactions sombres; elle utilise les deux transporteurs NADPH2 et ATP, rechargés lors des réactions photochimiques.
Ensuite, l’union de deux molécules de trioses forme un sucre à 6 atomes de carbone, le fructose-bisphosphate , puis monophosphate, pour lequel deux voies sont possibles: d’une part, la régénération du ribulose-bisphosphate , par des transformations entre glucides phosphorylés, permettant la poursuite de la fixation du dioxyde de carbone, et, d’autre part, l’engagement vers la formation d’accumulats glucidiques (fig. 9).
La régénération du ribulose-bisphosphate forme un cycle réactionnel auto-entretenu , ou cycle de Calvin, qui est parcouru en quelques secondes. L’excédent de carbone, dû à la fixation du dioxyde de carbone, est à l’origine de la synthèse de l’amidon qui se dépose fréquemment dans les chloroplastes.
Une fraction des trioses-phosphates émigre hors des chloroplastes et est à l’origine du saccharose, formé dans le cytosol. (L’enveloppe des chloroplastes est très perméable aux trioses-phosphates et au phosphate minéral.) Toutes ces réactions sont catalysées par des enzymes, et il est possible de les réaliser in vitro , à condition que les fournisseurs d’électrons et d’énergie soient présents. Il est remarquable de constater qu’elles mettent en jeu des composés phosphorylés qui appartiennent au métabolisme intermédiaire le plus courant. Les étapes allant de l’acide phosphoglycérique aux sucres parcourent exactement, en sens inverse, celles de la glycolyse fermentaire ou respiratoire, et la régénération du ribulose-bisphosphate emprunte la voie inverse de la chaîne respiratoire des pentoses-phosphates. C’est le pouvoir réducteur des chloroplastes, alimenté par la recharge photochimique de NADPH2 et de l’ATP, qui gouverne cette inversion.
L’originalité de ce cycle réactionnel réside dans le mode de fixation et de réduction du dioxyde de carbone, propre aux végétaux chlorophylliens et à de nombreuses bactéries autotrophes pour le carbone, et dans son couplage énergétique avec les réactions photochimiques.
Le cycle de Calvin comporte également quelques voies latérales qui aboutissent à la synthèse d’acides-aminés et de précurseurs des lipides (fig. 10). Ainsi, l’acide phosphoglycérique est à l’origine de l’acide pyruvique qui, par amination (fixation du groupe N H2), est transformé en 見-alanine, acide aminé à 3 atomes de carbone. La carboxylation de l’acide pyruvique donne naissance à l’acide oxaloacétique. Ce dernier peut être réduit, avec formation d’acide malique, ou aminé, avec synthèse d’acide aspartique. Ces trois derniers composés sont à 4 atomes de carbone et appartiennent à la même famille métabolique. L’acide pyruvique, par décarboxylation (perte de gaz carbonique), engendre le radical acétyle, origine des acides gras des lipides [cf. MÉTABOLISME].
Tout le déroulement du cycle de Calvin se situe dans les chloroplastes. À l’exception des trioses-phosphates, les glucides phosphorylés ne traversent que très lentement les membranes qui limitent ces organites; la voie synthétique des réactions se trouve ainsi compartimentée.
En revanche, trioses-phosphates et acides organiques circulent très aisément entre les chloroplastes et le cytosol.
Après migration dans le cytosol et les autres organites cellulaires, l’excédent des composés, par rapport aux nécessités du déroulement du cycle, alimente les synthèses de protéines, de lipides, etc. et la respiration.
5. Les types métaboliques de photosynthèse, d’après le mode de fixation initial de C2
Les réactions enzymatiques décrites ci-dessus sont sensiblement les seules voies d’entrée du C2 dans le métabolisme photosynthétique, pour la majorité des plantes primitivement étudiées. 90 p. 100 du carbone au moins empruntent directement la voie du phosphoglycérate, composé à 3 atomes de C, d’où le qualificatif de «type C3» donné à ces végétaux qui comprennent presque toutes les plantes originaires des régions tempérées, toutes les Fougères, Mousses, Algues et enfin tous les arbres quel que soit leur habitat climatique.
Mais, parmi les plantes herbacées et quelques arbustes des régions tropicales, semi-tropicales, ou encore des sols salés des régions tempérées, on trouve, dans près de vingt familles appartenant toutes aux Phanérogames Angiospermes, un procédé différent de fixation initial de C2. Celui-ci a été reconnu entre 1963 et 1966. Dans le cytosol des cellules sous-épidermiques de leurs feuilles (mésophylle) la réaction suivante intervient pour la quasi-totalité du C2 fixé. Elle est catalysée par une phosphoénolpyruvate carboxylase:

d’où l’expression de «plantes de type C4» qui leur a été attribuée. L’OAA, corps instable, y est immédiatement réduit en malate (MAL) ou aminé en aspartate (ASP). Ces deux derniers composés fournissent, après migration dans des cellules plus internes, le C2 à la réaction caractéristique du type C3:

Cette dernière a lieu dans les chloroplastes exclusivement. Ces cellules, plus internes que celles du mésophylle, entourent les vaisseaux conducteurs de sève et constituent la gaine périvasculaire (fig. 11). L’ensemble forme une structure dite en «couronne». Puis les opérations de réduction du PGA et de transformation des glucides, avec régénération du ribulose-bisphosphate, formation d’amidon et de saccharose, se poursuivent comme dans les plantes de type C3. La figure 12 schématise les 2 cycles réalisés, l’un dans les cellules du mésophylle, l’autre dans celles de la gaine périvasculaire. Ainsi l’ensemble du métabolisme photosynthétique du carbone se trouve réparti entre deux tissus dont les cellules ont une compartimentation enzymatique nettement diversifiée.
De plus, le type C4 présente plusieurs variantes. Pour le maïs, la canne à sucre, le malate est le transporteur essentiel de C2 et, dans les chloroplastes des cellules des gaines, une enzyme malique catalyse la réaction:
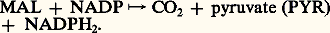
Le malate fournit le C2 et enrichit également le pouvoir réducteur des chloroplastes des gaines en réduisant le NADP en NADPH2. Pour d’autres espèces de type C4: Panicum maximum , Chloris guyana , l’aspartate, après amination de l’oxaloacétate dans le cytoplasme des cellules du mésophylle, émigre dans les gaines, y régénère l’OAA qui enfin fournit le C2 aux chloroplastes de ces dernières, après une décarboxylation par une PEP-carboxykinase selon une réaction du type:
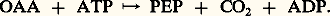
Le phosphoénolpyruvate, à l’état de pyruvate, est ensuite aminé, donnant naissance à l’ 見-alanine qui retourne dans le mésophylle, assurant la fourniture à la fois d’un chaînon tricarboné et d’une fonction aminée nécessaire à la poursuite du cycle.
Pour les espèces telles que Amaranthus edulis , Panicum miliaceum , où l’aspartate est également la principale forme de transport de C2 du mésophylle aux cellules des gaines, cet acide aminé est reconverti en malate dans les mitochondries des cellules des gaines et une enzyme malique assure la libération du C2 selon la réaction:

Après amination du pyruvate, avec formation d’ 見-alanine, le retour de cet acide aminé tricarboné permet la reprise du cycle dans les cellules du mésophylle.
Si, dans ces trois modalités, le cycle réducteur du C2 en glucides se situe toujours dans les chloroplastes des cellules des gaines périvasculaires et par le même processus incluant la carboxylation du ribulose-bisphosphate avec formation de PGA et réduction de ce dernier en trioses-phosphates, le mode d’apport de C2 à l’intérieur des tissus présente des modalités différentes. Le métabolisme photosynthétique du carbone est «éclaté», partagé entre des lieux cellulaires ou des organites divers: cytosol, chloroplastes, voire mitochondries, avec une spécialisation des cellules sous-épidermiques externes du mésophylle dans la fixation initiale du C2 et une spécialisation des chloroplastes des cellules plus interne des gaines dans sa réduction au niveau glucidique. Il en résulte une compartimentation du métabolisme différente de celle des plantes de type C3.
D’autres complications interviennent d’ailleurs, les chloroplastes des cellules du mésophylle pouvant participer à la réduction d’une fraction du phosphoglycérate venant des plastes des gaines, mais seuls les chloroplastes de ces dernières possèdent la ribulose-bisphosphate carboxylase.
Cet éclatement avec une compartimentation complexe implique diverses migrations de métabolites intermédiaires, facilitées par des communications directes (plasmodesmes entre les cytosols des différentes cellules en continuité, qu’elles appartiennent au mésophylle ou aux gaines). Cette compartimentation implique aussi une dépense énergétique supplémentaire correspondant à la multiplicité des transports et aux réactions plus nombreuses quand on compare le métabolisme C4 au métabolisme C3. Mais cette dépense supplémentaire est couverte par l’adaptation des plantes C4 au fort ensoleillement de leurs régions d’élection. Par ailleurs, ainsi qu’on l’exposera plus loin, à propos de la photorespiration, le pouvoir de fixation de C2 de la PEP-carboxylase est beaucoup plus élevé que celui de la ribulose-bisphosphate-carboxylase et leur assure une beaucoup plus grande activité métabolique de photosynthèse quand le flux lumineux n’est pas limitant.
Les plantes de type C4 sont capables d’absorber la totalité du C2 présent dans une enceinte close, ce que ne peuvent réaliser les plantes de type C3 dont la photosynthèse s’annule lorsque la pression partielle de C2 dans l’atmosphère s’abaisse au-dessous de 40 à 50 microlitres par litre d’air (point de compensation de CO2).
De ce fait, en atmosphère normale, les plantes de type C4 absorbent presque aussi rapidement le C2 dont le carbone est l’isotope 13C que le C2 à carbone 12C (le 13C2 représente environ 1,1 p. 100 du C2 total de l’air), alors que les plantes de type C3 présentent à l’égard du 13C2 un retard à l’assimilation de 20 p. 1 000 par rapport au 12C2 (fractionnement isotopique), contre 4 p. 1000 pour les plantes C4.
Elles peuvent utiliser des éclairements beaucoup plus élevés que les plantes de type C3. Leur saturation lumineuse n’est pas toujours atteinte dans les jours les plus riches en lumière (500 W par m2), alors que les plantes de type C3 sont saturées de lumière entre 50 et 150 watts par mètre carré. Leur optimum thermique de photosynthèse est également plus élevé (de 30 à 47 0C contre 15 à 25 0C pour les plantes C3).
La structure en couronne des tissus foliaires des plantes de type C4 est favorable à la migration des produits de photosynthèse, en raison de la proximité des cellules des gaines où se réalise la synthèse des glucides (amidon et saccharose) et des vaisseaux conducteurs de la sève qui distribuent les métabolites aux divers organes de la plante et peuvent ainsi leur assurer une croissance plus rapide, dans les conditions climatiques qui leur sont favorables.
Un autre avantage leur est aussi conféré dans leurs régions d’origine par leur économie hydrique, leur transpiration étant, en présence d’un ensoleillement fort, plus faible que celui des plantes C3 et leur rapport carbone assimilé/eau transitant dans les tissus plus élevé. Elles se trouvent sur la voie d’une adaptation aux climats arides dont le terme est donné par les plantes grasses au métabolisme acide crassulacéen (CAM) qui constitue un troisième type adapté aux conditions des déserts aux températures diurnes élevées. Au moins vingt-six familles de Phanérogames et quelques Fougères possèdent des espèces de type CAM.
En 1804, N. T. de Saussure avait décrit que les raquettes de figuier de Barbarie (Opuntia ) fixaient le C2 la nuit, quand les orifices de leurs stomates sont ouverts. Le jour, ils sont fermés et la transpiration de la plante est ainsi supprimée pendant la période de chaleur sèche de leur climat d’origine. La fixation aboutit alors, comme dans les plantes de type C4, à la formation de malate qui s’accumule durant la nuit, dans les vacuoles des cellules. Le jour suivant, à la lumière, le malate fournit le C2 nécessaire à la synthèse des glucides qui a lieu dans les chloroplastes. Il y a disjonction dans le temps entre la fixation initiale de C2 et sa réduction.
Il existe des espèces végétales dont les caractères sont intermédiaires entre les types métaboliques précédemment décrits, mais elles sont apparemment moins fréquentes que les types tranchés. Sans doute témoignent-elles des modalités d’évolution avortées ou en cours. Le type C3 est le plus primitif des trois, d’après les fossiles connus et les caractéristiques de la composition isotopique en carbone 13 et en carbone 12 des charbons. Il faut noter aussi que dans la même famille botanique (Caryophyllaceae , Chenopodiaceae , Euphorbiaceae... ) se trouvent des représentants des trois types métaboliques.
Enfin, des essais d’hybridation ont été tentés entre espèces voisines C3 et C4 appartenant au même genre (Atriplex ). Les croisements donnent des descendances viables, mais les nombreux caractères distinctifs, anatomiques, cytologiques, enzymatiques, dépendent de gènes différents. Ils se disjoignent avec une forte indépendance, une grande irrégularité dans la distribution chromosomique, qui, jusqu’à présent, n’a pu être maîtrisée en vue de conduire à une amélioration comparable à celle des plantes de grande culture telles que les blés ou les maïs.
6. Photosynthèse nette et photosynthèse brute; la photorespiration
À la lumière, les végétaux chlorophylliens continuent à respirer, c’est-à-dire à absorber de l’oxygène et à émettre du C2. Cette respiration possède plusieurs composantes. Les unes, tout à fait semblables à celles que l’on constate à l’obscurité, sont généralement déprimées à la lumière, l’énergétique lumineuse se substituant à l’énergétique chimique fournie par les oxydations mitochondriales.
De plus s’établit à la lumière un type de respiration particulier, appelé photorespiration (Pr).
Il en découle, sur le plan quantitatif, le fait suivant: l’émission photosynthétique d’2 ainsi que l’absorption de C2 observées à la lumière expriment la photosynthèse nette (Pn) qui est plus faible que la photosynthèse totale ou photosynthèse brute (Pb), selon l’équation: Pn = Pb 漣 Pr.
En fait, Pr représente l’«ensemble» de la respiration à la lumière comprenant essentiellement la photorespiration stricto sensu , si l’on néglige le faible reliquat des mécanismes respiratoires normalement manifestés à l’obscurité et qui se trouvent déprimés à la lumière.
L’importance de la photorespiration varie selon les types métaboliques décrits dans le paragraphe précédent. Pour les feuilles d’une plante de type C3, dont la photosynthèse nette peut atteindre 30 milligrammes de C2 fixé par décimètre carré et par heure, dans l’air ordinaire, la photorespiration peut avoir une valeur presque égale (soit 40 à 50 p. 100 de la photosynthèse brute) et se présenter comme une perte très importante du pouvoir photosynthétique total. Elle est en moyenne cinq fois plus intense que la respiration réalisée à l’obscurité par les mêmes organes.
En raison des échanges des mêmes gaz, quoique inversés, la mesure de la photorespiration est délicate.
La méthode la plus sûre est celle qui consiste à placer les végétaux en présence d’une atmosphère enrichie en oxygène de masse atomique 18 (non radioactif), distinct de l’oxygène courant de masse 16. Alors que par photosynthèse les végétaux libèrent 16O après photoxydation de l’eau H216O, la mesure de l’absorption de 18O par spectrométrie de masse permet d’évaluer l’intensité de la photorespiration. Si la durée de l’expérience d’appauvrissement de l’atmosphère en 18O n’est pas trop longue, afin d’éviter les échanges métaboliques d’oxygène, l’approche est quantitativement la plus fidèle. D’autres méthodes sont basées sur les échanges de C2: émission de ce gaz dans une atmosphère sans C2 qui balaie les feuilles et entraîne le C2 libéré par photorespiration, extrapolation à la concentration nulle des courbes d’intensité de la photosynthèse en présence de concentrations en C2 décroissantes, émission brusque de C2 après interruption de la lumière, traduisant d’une manière transitoire l’intensité de la photorespiration plus lente à s’annuler que la photosynthèse.
Réciproquement l’estimation de la photosynthèse brute peut être obtenue par la mesure de l’absorption de 14C2 pendant des temps très courts, précédant la mise en route du métabolisme photorespiratoire.
Les mesures par la voie des échanges de C2 donnent généralement des valeurs inférieures à celles obtenues avec l’isotope 18O de l’oxygène.
Le mécanisme de la photorespiration est complexe. D’une part, des transporteurs intermédiaires d’électrons (fig. 5) peuvent être directement oxydés par l’oxygène au niveau des membranes chloroplastiques, au voisinage du photosystème I. D’autre part, et c’est la voie la plus importante quantitativement, l’enzyme de fixation de C2, la ribulose-bisphosphate carboxylase, peut également fixer l’oxygène à la place du C2 et jouer le rôle d’une oxygénase (RuBP carboxylase/oxygénase est son nom complet actuel).
On pense que le même site enzymatique entre en jeu et qu’une compétition s’y manifeste entre les 2 petites molécules, C2 et 2, ce qui se traduit par une accélération de la photorespiration en présence d’atmosphères enrichies en 2 ou appauvries en C2 et, inversement, en sa quasi-disparition en présence d’atmosphères pauvres en 2 ou riches en C2.
La figure 13 résume les réactions mises en jeu par la fixation d’2 sur le ribulose-bisphosphate (RuBP) lorsque l’enzyme fonctionne comme oxygénase. Dans les chloroplastes, la fixation d’oxygène engendre non plus 2 molécules de phosphoglycérate comme lors de la fixation de C2, mais une seule molécule de phosphoglycérate et une molécule de phosphoglycolate, composé dont les 2 atomes de C proviennent du ribulose. Le phosphoglycolate, après déphosphorylation, fournit du glycolate qui émigre dans un autre organite cellulaire, un peroxysome. Il s’y trouve oxydé en glyoxylate avec formation d’eau oxygénée. L’enzyme, la glycolate oxydase, est strictement localisée dans les peroxysomes.
Ces derniers renferment aussi une catalase qui décompose l’eau oxygénée toxique. Une transaminase, présente également, catalyse la transformation du glyoxylate en glycine ou glycocolle aux dépens de glutamate fournisseur de fonction aminée. Ensuite la transformation de glycine en sérine a lieu dans les mitochondries, avec libération de C2, d’ammonium et réduction de nicotinamide adénine nucléotide, source d’une récupération partielle d’énergie. La sérine, après retour dans les peroxysomes, fournit du glycérate. Ce dernier après migration dans les chloroplastes et phosphorylation pourra, sous forme de phosphoglycérate, rentrer dans le cycle photosynthétique réductif du carbone. Toutes ces migrations de métabolites, d’organites en organites différents, sont imposées par les strictes localisations des enzymes, d’où résulte une compartimentation et un trajet métabolique compliqués de composés carbonés et azotés. L’ensemble se solde par la perte d’une molécule de C2 et l’absorption de 3 molécules d’2 pour 2 molécules de ribulose-bisphosphate oxydé.
Cette photorespiration n’est connue en fait que depuis les années 1960-1970. Elle représente une perte très variable du pouvoir photosynthétique selon les types végétaux. Très importante chez diverses plantes de type C3: blé, tabac, tournesol, soja, elle est beaucoup plus faible chez d’autres végétaux, appartenant cependant au même type métabolique. Il en est ainsi chez diverses algues d’eau douce ou marines qui excrètent du glycolate. Les plantes de type C4 ont aussi une photorespiration dont témoigne leur sensibilité aux pressions partielles élevées d’oxygène et la présence de peroxysomes dans leurs tissus, mais elle est effacée par la forte affinité de la phosphoénolpyruvate carboxylase qui retient le C2 libéré dans les tissus foliaires. Par suite, elle ne peut être décelée que par l’absorption de 18O.
La signification de la photorespiration reste énigmatique: conséquence initiale de la double activité de la protéine la plus abondante du monde, la ribulose-bisphosphate carboxylase/oxygénase, prix payé à sa structure moléculaire, élimination d’un excès de pouvoir réducteur fourni par les photosystèmes membranaires aux enzymes du stroma chloroplastique, fourniture d’acides aminés, sont des faits qu’une vision de finalité absolue tend à négliger.
Les essais de sa suppression par divers inhibiteurs d’enzymes tels que la glycolate oxydase n’ont pas jusqu’à présent réussi à améliorer la production végétale par une intensification de la photosynthèse. Son effacement, dans les plantes de types C4, est dû, non à la suppression de son mécanisme, mais à la mise en jeu d’une procédure plus efficace de fixation de C2 que celle qui est réalisée dans les plantes de type C3.
7. Énergétique et importance de la photosynthèse dans la biosphère
Le bilan de la photosynthèse nette laisse un excédent de substances organiques très important, puisque les pertes totales dues à la respiration de tous les organes végétaux ne dépassent pas 40 à 50 p. 100 du gain positif de synthèse nette.
D’une manière générale, la vitesse ou intensité de la photosynthèse croît avec l’intensité de l’éclairement, jusqu’à une valeur limite, au-delà de laquelle la saturation lumineuse est atteinte, comme il est indiqué à propos des différents types métaboliques de photosynthèse. Pour les plantes de type C3, qui représentent les plus grandes masses de végétation, cette saturation est nettement inférieure à l’intensité maximale de la lumière qui arrive au sol (500 W/m2 environ). En revanche pour ces plantes, la tension partielle de C2 dans l’atmosphère (330 猪l/l d’air) est un facteur limitant, ce qui explique le succès de la fertilisation des cultures sous abri, par apport de dioxyde de carbone dans l’air. Le doublement de la concentration partielle de C2 multiplie par 2 en moyenne l’intensité de la photosynthèse des plantes de type C3, alors qu’elle est sans effet sur les plantes de type C4.
Enfin, comme dans tout mécanisme lié à l’activité d’enzymes, la vitesse de la photo synthèse est sensible à la température, elle augmente jusqu’à un optimum variable selon les espèces et en particulier selon le type métabolique (voir chap. 5), puis décroît ensuite rapidement par suite d’une désorganisation de l’appareil photosynthétique. Notons cependant que quelques organismes thermophiles, appartenant aux Photobactéries ou aux Cyanophycées (Cyanobactéries ou «algues bleues») supportent des températures voisines de 60-70 0C. La sensibilité de la photosynthèse à la fois à l’intensité de l’éclairement et à la température souligne bien l’existence des 2 types de réactions: photochimiques d’une part, sombres (ou «thermiques») d’autre part.
Lorsque deux des trois facteurs externes (lumière, température, concentration partielle de C2) sont optimaux, l’intensité de la photosynthèse dépend de la valeur du troisième, selon la loi très générale dite loi du minimum [cf. NUTRITION]. Lorsque les trois facteurs sont à l’optimum, l’intensité atteint un plafond absolu qui dépend de l’équipement pigmentaire et enzymatique d’un végétal, donc de facteurs propres à l’organisme.
De fait, la vitesse optimale n’est jamais atteinte dans les conditions naturelles, et il en est de même du rendement énergétique défini par le rapport entre le C2 assimilé, ou l’oxygène émis, et l’énergie lumineuse absorbée.
Dans les meilleures conditions expérimentales de laboratoire, l’exigence quantique de la photosynthèse peut être de 8 à 10 quanta par molécule de C2 fixé, soit égale ou très voisine du minimum théorique de photons, tel que l’on peut le déduire d’après les données du paragraphe 3 et de la figure 5.
Il faut souligner d’ailleurs que cette exigence photonique minimale, correspondant à un rendement énergétique maximum d’environ 30 p. 100, n’est obtenue qu’en présence d’éclairements très faibles.
En présence des éclairements naturels, le rendement énergétique maximal de la photosynthèse nette ne dépasse pas 10 à 15 p. 100, correspondant à une exigence quantique de 20 à 30 photons. Si l’on tient compte du rythme nycthéméral d’éclairement, le rendement énergétique rapporté à un cycle naturel de 24 heures ne dépasse pas 7 à 10 p. 100. En moyenne, pendant les périodes de végétation active, il ne dépasse pas 4 à 8 p. 100 (betterave, blé, par ex.) par rapport à l’énergie lumineuse arrivant au sol pour les plantes de culture des régions tempérées et 6 à 8 p. 100 pour celles des régions subtropicales ou tropicales (canne à sucre, par exemple).
Cependant et bien que les végétaux, à l’exception des forêts très touffues, soient loin d’utiliser la totalité, voire la majeure partie de la lumière qui parvient à leur niveau, les quantités de carbone fixées annuellement et les synthèses de matières organiques sont énormes.
Les estimations fondées sur les récoltes et la mesure de la croissance des arbres indiquent que les végétaux terrestres accumuleraient annuellement environ 50 milliards de tonnes de carbone et les végétaux marins environ 20 milliards de tonnes, correspondant au total à un excédent de synthèse de substances organiques de 170 milliards de tonnes. Il y correspond un stockage d’énergie de l’ordre de 2,7 憐 108 kJ qui est environ 10 fois plus grand que la consommation annuelle mondiale d’énergie.
Il faut aussi se souvenir de l’origine végétale du charbon, des bitumes et pétroles pour estimer l’importance de la photosynthèse à sa juste valeur. On lui doit aussi la purification de l’air par la soustraction du dioxyde de carbone et le dégagement d’oxygène.
Il est probable que la totalité du carbone présent sur la terre comme celle de l’oxygène de l’air et de l’eau sont passées de nombreuses fois par le mécanisme photosynthétique (cf. BIOSPHÈRE et CYCLES BIOGÉOCHIMIQUES).
Aussi comprend-on qu’actuellement nombre de chercheurs, scientifiques ou économistes estiment qu’un accroissement de la photosynthèse, ou une plus efficace utilisation de ses produits, puisse contribuer à la satisfaction des besoins énergétiques mondiaux. Les «biotechnologies solaires» s’en préoccupent activement. Multiformes, encore en quête d’être complètement adoptées, elles prétendent prolonger l’agronomie classique (sélection végétale), orienter partiellement la production végétale (cultures énergétiques), mieux tirer parti des déchets d’origine agricole (biogaz) ou forestière (combustion). Bien plus, elles visent à exploiter le phénomène en conditions semi-artificielles (cultures d’algues pour la production de molécules à haute valeur ajoutée) ou même à l’imiter pour le perfectionner (voie biomimétique): cet aspect du sujet est examiné dans l’article Biomasse in ÉNERGIES RENOUVELABLES.
photosynthèse [ fɔtosɛ̃tɛz ] n. f.
• 1902; de photo- et synthèse
♦ Biol. Production de glucides par les plantes et certaines bactéries à partir de l'eau et du gaz carbonique de l'air qu'elles peuvent fixer grâce à la chlorophylle, en employant comme source d'énergie la lumière solaire. — Adj. PHOTOSYNTHÉTIQUE , (1902) .
● photosynthèse nom féminin Chez les végétaux et certaines bactéries, en présence de lumière, réaction biochimique qui, à partir de molécules minérales simples (CO2, H2O …), produit des molécules organiques glucidiques de relativement faible masse molaire. (Certaines de ces molécules sont polymérisées en glucides de masse molaire élevée [amidon], d'autres se transforment en lipides, d'autres enfin s'unissent à des molécules azotées. Le phénomène est caractérisé par une absorption de dioxyde de carbone et par un dégagement d'oxygène.) ● photosynthèse (synonymes) nom féminin Chez les végétaux et certaines bactéries, en présence de lumière...
Synonymes :
photosynthèse
n. f. BIOL, BOT Synthèse de substances organiques effectuée par les plantes vertes exposées à la lumière.
Encycl. La photosynthèse consiste en la transformation de l'énergie lumineuse en énergie chimique: à partir du gaz carbonique atmosphérique et de l'eau, les plantes vertes réalisent la synthèse de glucides (substances organiques riches en énergie) grâce à l'énergie lumineuse emmagasinée par la chlorophylle, pigment contenu dans les feuilles de ces plantes.
⇒PHOTOSYNTHÈSE, subst. fém.
BIOL. Ensemble des phénomènes qui participent à la production de glucides par les végétaux verts à partir de l'eau et du gaz carbonique de l'air qu'ils peuvent fixer et transformer en matière organique grâce à la chlorophylle, et en utilisant, comme source d'énergie, le rayonnement solaire. D'après Rabinovitch (1945), la photosynthèse concourt à la production de 300 milliards de tonnes de matière organique par an, fait qui prend une importance réelle sur le plan géologique (Hist. gén. sc., t.3, vol. 2, 1964, p.498). V. aussi assimilation ex. 2.
Prononc.:[ ], [foto-]. Étymol. et Hist. 1902 (MACCHIATI ds Comptes Rendus de l'Ac. des Sc., t.135, p.1128 d'apr. H. COTTEZ ds QUEM. DDL t.25). Comp. de l'élém. formant photo-1 et de synthèse d'apr. l'all. Photosynthese (NED Suppl.2, s.v. photosynthesis).
], [foto-]. Étymol. et Hist. 1902 (MACCHIATI ds Comptes Rendus de l'Ac. des Sc., t.135, p.1128 d'apr. H. COTTEZ ds QUEM. DDL t.25). Comp. de l'élém. formant photo-1 et de synthèse d'apr. l'all. Photosynthese (NED Suppl.2, s.v. photosynthesis).
 ], [foto-]. Étymol. et Hist. 1902 (MACCHIATI ds Comptes Rendus de l'Ac. des Sc., t.135, p.1128 d'apr. H. COTTEZ ds QUEM. DDL t.25). Comp. de l'élém. formant photo-1 et de synthèse d'apr. l'all. Photosynthese (NED Suppl.2, s.v. photosynthesis).
], [foto-]. Étymol. et Hist. 1902 (MACCHIATI ds Comptes Rendus de l'Ac. des Sc., t.135, p.1128 d'apr. H. COTTEZ ds QUEM. DDL t.25). Comp. de l'élém. formant photo-1 et de synthèse d'apr. l'all. Photosynthese (NED Suppl.2, s.v. photosynthesis).DÉR. Photosynthétique, adj. Relatif à la photosynthèse. Processus photosynthétique; réaction photosynthétique. La mesure des échanges gazeux chlorophylliens permet d'apprécier l'intensité de la photosynthèse, donc l'activité photosynthétique d'un végétal (CAMEFORT, GAMA, Sc. nat., 1960, p.328). — [ ], [foto-]. — 1re attest. 1902 assimilation photosynthétique (MACCHIATI ds Comptes Rendus de l'Ac. des Sc., t.135, p.1128 d'apr. H. COTTEZ ds QUEM. DDL t.25); de photosynthèse, suff. -ique.
], [foto-]. — 1re attest. 1902 assimilation photosynthétique (MACCHIATI ds Comptes Rendus de l'Ac. des Sc., t.135, p.1128 d'apr. H. COTTEZ ds QUEM. DDL t.25); de photosynthèse, suff. -ique.
 ], [foto-]. — 1re attest. 1902 assimilation photosynthétique (MACCHIATI ds Comptes Rendus de l'Ac. des Sc., t.135, p.1128 d'apr. H. COTTEZ ds QUEM. DDL t.25); de photosynthèse, suff. -ique.
], [foto-]. — 1re attest. 1902 assimilation photosynthétique (MACCHIATI ds Comptes Rendus de l'Ac. des Sc., t.135, p.1128 d'apr. H. COTTEZ ds QUEM. DDL t.25); de photosynthèse, suff. -ique.
photosynthèse [fɔtosɛ̃tɛz] n. f.
ÉTYM. 1902, Macchiati, in Rev. gén. des sc., 15 janv. 1903, p. 50; de photo-, et synthèse.
❖
♦ Biol. Production de glucides par les plantes à partir du gaz carbonique de l'air qu'elles peuvent fixer grâce à la chlorophylle, en employant comme source d'énergie la lumière solaire.
0 La photosynthèse est le processus qui permet aux plantes d'utiliser l'énergie de la lumière pour fabriquer, à partir du gaz carbonique, les glucides qui seront la matière première de toute la substance vivante : la photosynthèse est la réaction qui fait pénétrer le carbone dans le cycle vital.
Jules Carles, l'Énergie chlorophyllienne, p. 37.
➪ tableau Vocabulaire de la chimie.
❖
DÉR. Photosynthétique.
Encyclopédie Universelle. 2012.