ANTIMOINE
L’antimoine est l’élément chimique métallique de symbole Sb (du latin stibium ), de numéro atomique 51. C’est un solide brillant de couleur argentée. Il est assez rare: les deux tiers des éléments naturels sont plus abondants que lui dans la croûte terrestre. Toutefois, il se rencontre, en certains endroits, sous forme de minerais riches, souvent associés à ceux de plomb, de cuivre et d’argent. De ce fait, il est plus accessible que d’autres éléments, globalement plus abondants, mais plus disséminés. Il existe à l’état natif, pur ou mêlé à de l’arsenic avec lequel il constitue des cristaux mixtes; on trouve aussi les oxydes Sb23 et Sb24; cependant, le minerai le plus important est un sulfure, la stibine Sb2S3.
Les principaux pays producteurs du minerai sont la Chine, où se trouvent les plus grosses réserves mondiales, l’Afrique du Sud, l’ex-U.R.S.S., la Bolivie, le Mexique et l’ex-Yougoslavie.
Le métal n’est plus utilisé à l’état pur, mais ses alliages sont relativement importants. On l’ajoute au plomb pour améliorer sa dureté dans les batteries d’accumulateurs ou les caractères d’imprimerie et aux alliages antifriction à base de plomb, d’étain et de cadmium. Quelques composés de l’antimoine sont utilisés dans des peintures, dans la fabrication de matériaux ignifuges et de munitions, ainsi que dans l’industrie pharmaceutique.
1. Historique
Un vase chaldéen en antimoine pur datant d’environ quatre mille ans avant notre ère a été retrouvé.
Les Égyptiens des Ve et VIe dynasties se servaient de récipients en cuivre recouvert d’antimoine pour le transport de l’eau.
La Bible mentionne le sulfure d’antimoine: Jézabel se fardait les yeux avec de la stibine. Cette pratique était répandue parmi les Égyptiens pour des raisons à la fois d’esthétique et d’hygiène; Grecs, Romains et Chinois connaissaient également ses vertus curatives. Au XVe siècle, un personnage mystérieux, le moine Basile Valentin, décrit dans un pamphlet célèbre, Triumphwagen des Antimonii (Le Char triomphal de l’antimoine ), les propriétés de la plupart des composés usuels à côté de la préparation du métal et de ses alliages. Partant de la capacité qu’a l’antimoine de libérer l’or de ses impuretés, il lui attribuait les mêmes effets sur l’organisme humain.
L’utilisation des composés antimoniés en thérapeutique interne fut fréquente à la fin du XVIe siècle. Des abus entraînèrent de nombreux accidents mortels et furent à l’origine d’une querelle entre les facultés de Montpellier et de Paris. Cette dernière en fit même interdire l’emploi. Cependant, les dérivés organiques de l’antimoine sont encore utilisés de nos jours dans la lutte contre divers parasites internes. À cette vulgarisation des composés antimoniés se rattache un vocabulaire désuet et curieux qui a parfois subsisté jusqu’à nos jours: le kermès minéral est l’oxysulfure naturel et l’émétique (ou tartre stibié) est un dérivé tartrique d’antimoine et de potassium. Le trioxyde, l’oxychlorure, le pentasulfure et le trichlorure étaient appelés respectivement fleurs argentines d’antimoine, poudre d’algaroth, soufre doré et beurre d’antimoine.
2. Caractéristiques
L’antimoine est le quatrième élément de la cinquième colonne de la classification périodique; il succède à l’azote, au phosphore, à l’arsenic et précède le bismuth. Les propriétés physico-chimiques de ces éléments évoluent, du haut en bas de la colonne, dans le sens d’un renforcement du caractère métallique, inexistant chez les deux premiers, exclusif dans le cas du bismuth. L’antimoine possède plusieurs variétés allotropiques cristallines rattachées par leurs propriétés, soit aux métaux, soit aux éléments non métalliques. Le caractère intermédiaire de l’antimoine se traduit aussi par une faible tendance à donner des composés de degré d’oxydation 漣 III, représentés essentiellement par des dérivés organiques, tandis que les composés + III sont les plus nombreux et que la stabilité du degré + V est plus faible que chez l’arsenic. Par l’ensemble de ses propriétés, l’antimoine est très proche de l’arsenic, avec un caractère métallique plus accentué. Le potentiel électrochimique de l’antimoine (0,15 V) le situe dans le groupe des métaux nobles, entre l’hydrogène (0,00 V) et le cuivre (0,35 V). Contrairement à l’azote, au phosphore et à l’arsenic, il ne semble pas avoir un rôle biologique important.
Cortège électronique. Modes de liaison
Le cortège électronique de l’antimoine se compose de 2 électrons K, 8 électrons L, 18 électrons M et 18 électrons N qui constituent le cœur chimiquement inerte de l’atome. La couche externe O, de valence, possède cinq électrons répartis entre un doublet 5s et 3 électrons non appariés, chacun sur une orbitale 5p (tabl. 1).
L’atome d’antimoine est difficile à ioniser. Les antimoniures métalliques ont des réseaux partiellement ioniques et partiellement covalents dans lesquels les ions Sb3- n’ont pu être caractérisés. L’ion Sb5+ n’existe pas, mais Sb3+ est connu, ce qui n’est pas le cas de son homologue arsénié. Comme dans le cas de l’arsenic, deux principaux modes de liaison sont possibles pour les composés trivalents, avec comme conséquence des propriétés structurales différentes. S’il n’y a pas hybridation des orbitales, les liaisons sont assurées par les orbitales p , le doublet s restant inerte; les angles de liaison sont alors voisins de 900; dans le cas d’une hybridation de type sp 3, l’une des orbitales reste non liante et les quatre directions de liaison sont entièrement symétriques dans l’espace. Le premier type de structure est de loin le plus rare, représenté seulement dans certaines variétés de l’oxyde, du sulfure et de l’oxychlorure.
L’antimoine, comme le zirconium, son homologue dans la colonne voisine, et surtout le bismuth, qui lui succède dans la même colonne, présente la particularité de constituer avec un atome d’oxygène un ion stable Sb+, appelé antimonyle, qui conduit à des sels le plus souvent ioniques mais parfois covalents. Les sels d’antimonyle sont des intermédiaires entre le sel neutre et l’oxyde au cours de l’hydrolyse du chlorure, du nitrate, du sulfate, etc.
Propriétés
L’antimoine existe sous trois ou quatre variétés cristallines différentes. À l’état stable, l’antimoine gris, métallique, conduit l’électricité, il est insoluble dans le sulfure de carbone, sa structure est identique à celle de l’arsenic et du bismuth: les atomes sont répartis dans des feuillets plissés, chacun d’eux étant au sommet d’une pyramide triangulaire régulière. Au phosphore blanc et à l’arsenic correspond une variété très instable, l’antimoine jaune, obtenue à 漣 100 0C par action d’oxygène gazeux sur l’hydrure SbH3 liquide. L’antimoine jaune est décomposé dès 漣 80 0C en antimoine mal défini. L’antimoine est alors constitué de molécules tétraédriques qui, par réchauffement, laissent place à une structure vitreuse dans laquelle chaque atome possède quatre voisins à 0,287 nm et deux autres à 0,351 nm. Une autre variété, l’antimoine explosif, a été préparée par électrolyse, sous forte densité de courant, d’une solution chlorhydrique de chlorure d’antimoine; sa structure n’est pas connue; à 200 0C elle se transforme en antimoine usuel avec explosion; selon certaines hypothèses, il s’agirait d’un gel d’antimoine métallique retenant un peu d’halogénure.
La vapeur émise à la température d’ébullition est constituée de molécules Sb4 qui se dissocient progressivement lorsque la température s’élève.
L’antimoine métallique est peu réactif. Il ne décompose l’eau que chauffé au rouge. Il résiste bien à l’oxydation, même à l’air humide; porté à une haute température, il brûle avec une flamme brillante en formant du trioxyde Sb46, semblable en cela à l’arsenic et différent du phosphore, qui passe directement au degré d’oxydation + V.
Dans le chlore, l’antimoine s’enflamme spontanément; la réaction doit être provoquée par chauffage dans le cas du brome, de l’iode et du soufre.
Il se dissout lentement dans les acides sulfurique et nitrique concentrés. L’insolubilité de l’antimoine dans les acides chlorhydrique ou sulfurique dilués résulte de son caractère de métal noble: à pH = 0 et en solution molaire, son potentiel d’électrode n’est que de 0,21 V. Le potentiel varie en fonction du pH. Un barreau d’antimoine peut donc être facilement utilisé pour la mesure du pH en milieu ni trop acide ni trop basique. Cependant, cette électrode robuste n’est pas fidèle: les résultats sont difficilement reproductibles à quelques semaines d’intervalle.
3. Composés de l’antimoine
Composés oxygénés
L’oxyde d’antimoine III peut être produit soit par oxydation directe du métal fondu, soit par hydrolyse de sels, en particulier du chlorure en milieu faiblement basique. Deux variétés cristallines, stables à haute et basse températures, sont connues à l’état naturel, car le passage à la variété stable, à la température ambiante, est extrêmement lent (tabl. 2).
La variété cubique cristallise sous forme d’octaèdres: comme dans le cas de l’oxyde d’arsenic, le réseau est analogue à celui du diamant, dans lequel les groupes Sb46 occupent les positions habituelles des atomes de carbone. La forme stable à haute température possède une structure en chaînes formées alternativement d’un atome d’antimoine et d’un atome d’oxygène. Ces chaînes sont pontées entre elles par des atomes d’oxygène situés entre deux atomes d’antimoine. Par chauffage, cet oxyde peu stable évolue rapidement et réagit avec les composés ou éléments placés à son contact. Dans l’air, il se transforme en oxyde mixte Sb24; dans un courant d’hydrogène ou en présence de carbone, il est facile à réduire et, mélangé à du soufre, il passe à l’état de trisulfure. Comme l’oxyde d’arsenic homologue, cet oxyde d’antimoine est indifférent, avec accentuation nette du caractère basique. Il est très peu soluble dans l’eau et les acides dilués; avec les acides concentrés, il donne des sels d’antimoine III, comme le sulfate Sb2(SO4)3 ou le nitrate Sb(NO3)3; il est également soluble dans plusieurs acides organiques, dont l’acide tartrique. Par action des bases, il se forme des méta-antimonites, comme NaSb2, 3H2O dans le cas de la soude. Par hydrolyse, à basse température, des gels d’oxyde hydraté ont été préparés; ils perdent leur eau très facilement. Aucun hydrate défini n’a pu être isolé. Le trioxyde chauffé dans l’air absorbe de l’oxygène dès 300 0C pour donner l’oxyde Sb24 qui se décompose au-delà de 900 0C en redonnant le trioxyde. Ce composé doit être considéré comme un antimoniate antimonieux: SbIII(SbV4); cette structure est attestée par l’action d’une solution de potasse qui conduit à un mélange d’antimoine et d’antimoniate de potassium; par ailleurs, la structure est identique à celle du tantalate d’antimoine SbIII(TaV4). L’oxyde d’antimoine V se forme par action de l’acide nitrique concentré sur une solution antimonieuse. L’oxyde hydraté obtenu peut être difficilement déshydraté sans perte d’oxygène. Aucun acide antimonique n’a pu être isolé des solutions qui contiennent un monoacide hexahydroxylé de formule H(Sb(OH)6) et dont la constante de dissociation vaut 5 . 105. Les sels correspondants de sodium et de potassium sont bien connus. Les antimoniates anhydres peuvent être préparés par voie sèche, par fusion d’oxydes en proportion stœchiométrique; ils ont une structure complexe et, en particulier, les diantimoniates de métaux divalents, comme Ca2Sb27, semblent suggérer l’existence d’un acide pyroantimonique, à rapprocher de l’acide pyrophosphorique, alors qu’en réalité aucun groupe Sb272- n’existe dans le cristal; celui-ci possède un réseau continu comme celui de certains silicates ou aluminosilicates.
Autres sels d’antimoine
Les sulfures, correspondant aux deux degrés d’oxydation, sont faciles à préparer par action directe du soufre, en proportions calculées, sur l’antimoine métallique, ou par voie aqueuse, en faisant agir un courant d’hydrogène sulfuré sur une solution acide d’antimoine tri- ou pentaoxydé. Ces sulfures sont proches des sulfures d’arsenic: en milieu très acide ou basique, ils se dissolvent en conduisant aux sels d’antimoine, aux antimonites ou aux antimoniates; en présence de sulfure d’ammonium, ils se transforment en thiosels solubles, de formules (NH4)3SbS3 et (NH4)3SbS4.
Alors que le trisulfure naturel et celui qui est préparé par voie sèche sont noirs, le produit obtenu par précipitation aqueuse a une belle couleur rouge-orangé; il est amorphe et cristallise par chauffage en noircissant; si la vapeur est refroidie très brutalement, le sulfure vitreux orangé peut être obtenu.
Les trihalogénures d’antimoine sont préparés par union directe des éléments ou, le plus souvent pour le fluorure et le chlorure, par action de l’hydracide sur l’oxyde ou le sulfure. Le pentafluorure, obtenu par action d’acide fluorhydrique sur le pentachlorure, et ce dernier, par halogénation directe, avec un gros excès de chlore, sont les seuls halogénures de degré V qui aient été préparés. En solution aqueuse, ces halogénures s’hydrolysent totalement avec formation intermédiaire de sels d’antimonyle. Le chlorure d’antimonyle peut être précipité par simple dilution d’une solution de chlorure d’antimoine; il est peu soluble dans l’alcool ou l’éther; dans l’eau, l’hydrolyse se poursuit pour conduire finalement à l’oxyde. Dans les solutions très acides, il semble que les ions Sb3+ existent: par électrolyse, le métal se dépose à la cathode, ce qui représente par rapport à l’arsenic une augmentation nette du caractère métallique.
Les halogénures donnent de nombreux complexes avec des ions ou des molécules jouant le rôle de donneurs de doublet électronique, comme les halogènes et de nombreuses molécules organiques possédant des fonctions éther, aldéhyde, thiol et même des carbures aromatiques.
Les solutions chlorhydriques de tri- et de pentachlorure d’antimoine sont pratiquement incolores; en les mélangeant, la solution devient brune et l’intensité de la coloration est proportionnelle au produit des concentrations de chaque sel. La formation d’un dimère Sb2Cl8 serait responsable de cette coloration. Si ces solutions sont additionnées de chlorures alcalins lourds, des sels très colorés, bruns à violets, précipitent; leurs formules s’écrivent: Rb2(SbCl6), Cs2(SbCl6) et également (NH4)2(SbBr6). Tous ces composés semblent correspondre au degré d’oxydation IV, inconnu par ailleurs dans la chimie de l’antimoine. La structure cristalline, déterminée par diffraction de rayons X, est identique à celle de K2(PtCl6), ce qui prouve que les atomes d’antimoine sont tous au même degré d’oxydation et non pas moitié de degré III et moitié de degré V. Pour expliquer ces faits, Linus Pauling a suggéré qu’il pourrait s’agir d’un cas de mésomérie, la formule réelle étant intermédiaire entre les deux cas limites (SbX6)3 - et (SbX6) - de structure cristalline identique.
Hydrure et dérivés organiques
L’hydrogène antimonié, ou stibine de formule SbH3, est encore moins stable que son homologue arsénié. La synthèse directe, à partir des éléments, n’est pas réalisable et la réduction, par un mélange zinc-acide sulfurique, d’un composé quelconque de l’antimoine n’aboutit pratiquement qu’à un dépôt de métal. La seule préparation efficace consiste à traiter, par une solution chlorhydrique, un alliage de magnésium et d’antimoine dans la proportion correspondant à l’antimoniure Mg3Sb2. La stibine est un gaz très toxique, liquéfié dès 漣 18 0C, facilement décomposé par la chaleur et oxydable avec dépôt d’antimoine métallique et formation d’eau. Les dérivés alcoylés et arylés de la stibine sont, en règle générale, comparables à leurs homologues arséniés, mais moins stables et plus difficiles à préparer, l’énergie de la liaison Sb 漣 C étant plus faible que celle de la liaison As 漣 C. Seuls les dérivés trisubstitués sont connus; les stibines primaires et secondaires n’ont jamais pu être obtenues. Les distibines sont d’une synthèse délicate: on utilise la méthode de Paneth, qui consiste à faire agir des radicaux libres méthyle ou éthyle sur un miroir d’antimoine déposé dans un tube de verre. Les stibines aliphatiques sont très sensibles à l’oxydation: les plus légères s’enflamment spontanément dans l’air; elles fixent quantitativement les halogènes, le soufre et le sélénium. Les composés stibonium quaternaires existent; ils ne possèdent jamais plus d’un groupe aromatique sur l’atome d’antimoine. Les stibines aromatiques sont stables; il est possible de les sulfoner, de les nitrer, de réduire le groupe nitro des groupes aryles sans détruire la liaison Sb 漣 C. Les acides stiboniques sont peu stables; ils se présentent sous forme d’une poudre blanche, amorphe, fortement polymérisée.
4. Chimie analytique
La recherche analytique qualitative se fait par isolement du sulfure, dont la couleur orangée est très remarquable. Le dosage volumétrique est possible avec une solution d’iode, en présence d’acide tartrique et de carbonate de sodium pour stabiliser le pH:

La caractérisation d’antimoine ou d’arsenic pose un problème délicat en toxicologie. L’empoisonnement aigu par l’antimoine offre de nombreuses analogies avec l’empoisonnement aigu par l’arsenic. L’empoisonnement chronique est plus rare; il se rapproche également de l’empoisonnement arsenical chronique. La séparation peut se faire grâce aux essais suivants: l’antimoine, contrairement à l’arsenic, n’est pas soluble dans une solution d’hypochlorite de sodium ou dans un mélange de soude et d’eau oxygénée; en outre, l’arsenic est très facilement volatil, ce qui n’est pas le cas de l’antimoine.
5. Préparation
Lorsqu’on dispose de minerais à haute teneur, la stibine, très fusible, est directement fondue vers 600 0C avec du fer, qui se sulfure tandis que l’antimoine liquide coule sous la scorie. Dans la plupart des cas, les stibines naturelles subissent une fusion préalable qui les débarrasse de leur gangue et qui donne l’antimoine «cru» à l’aspect vitreux, que l’on grille dans un courant d’air. L’oxyde obtenu est réduit par du charbon de bois, en présence de carbonate de sodium. L’antimoine de haute pureté résulte d’une électrolyse.
6. Applications
Intérêt thérapeutique
Le métal est toxique à forte dose: il provoque alors une intoxication aiguë se traduisant par des vomissements et des diarrhées (syndrome cholériforme = choléra stibié).
Les composés minéraux, très utilisés au XVIIe siècle, sont à peu près abandonnés, sauf le trichlorure SbCl3 obtenu par l’action de l’acide chlorhydrique sur la stibine. Les composés organiques sont des antiparasitaires. Le plus ancien est l’émétique, préparé par dissolution d’oxyde d’antimoine dans du tartrate acide de potassium. Sa formule est cyclique:

C’est un solide pulvérulent, de couleur blanche, assez soluble dans l’eau. Connu comme vomitif énergique, c’est aussi un dépresseur du système nerveux central et périphérique, du système musculaire, de la respiration et de la circulation. On lui a préféré le dérivé sodé, plus soluble et moins toxique, administré par injection sous-cutanée ou intramusculaire dans le traitement de certaines maladies tropicales: bilharziose, kala-azar, leishmaniose, etc. D’autres dérivés sont administrés maintenant par voie intraveineuse dans le traitement de ces mêmes maladies; ce sont en général des dérivés de la stibamine H2NC6H4Sb3H2.
Emploi dans les alliages
Près de la moitié de la production mondiale annuelle (qui s’élève à 70 000 t environ) est consommée comme élément durcissant dans les alliages à base d’étain et surtout de plomb. Les plaques des batteries d’accumulateurs, qui doivent présenter une grande résistance, sont constituées de plomb allié à environ 6 p. 100 d’antimoine. Ce dernier confère en plus une meilleure coulabilité et une meilleure résistance à la corrosion chimique.
Ce pourcentage d’antimoine peut s’élever jusqu’à 20 p. 100 dans l’alliage ternaire (plomb, antimoine, étain) des caractères d’imprimerie, lorsque la meilleure définition possible de ces derniers est recherchée. On utilise alors la propriété qu’a l’antimoine, à l’inverse du plomb et de l’étain, de se dilater légèrement au refroidissement.
L’antimoine est également un constituant essentiel des alliages antifriction à base d’étain. La phase dure qui supporte la charge et résiste à l’usure est formée de cristaux d’étain et d’antimoine. Cette phase est enrobée dans une matrice plus douce et plus plastique à base de cuivre et d’antimoine.
L’antimoine intervient encore dans la composition du métal anglais (étain: 93 p. 100; antimoine: 5 p. 100; cuivre: 2 p. 100), avec lequel sont fabriqués des services de table, des couverts...
Autres applications
En plus de leur intérêt thérapeutique, les composés de l’antimoine ont, en petites quantités, des usages variés. Le trioxyde est un constituant des peintures blanches et un opacifiant des émaux blancs. Les sulfures servent à vulcaniser le caoutchouc, qu’ils colorent en rouge. Oxydés en oxysulfures, ils sont connus en peinture fine sous le nom de vermillon d’antimoine, tandis que le jaune de Naples est constitué d’antimoniate de plomb.
Des tissus sont ignifugés par immersion dans une solution de trioxyde ou de trichlorure d’antimoine dans des solvants organiques chlorés. Après le traitement, les flammes accompagnant une éventuelle combustion sont éteintes par les produits imprégnés qui se dégagent sous l’action de la chaleur.
antimoine [ ɑ̃timwan ] n. m.
• XIIIe; lat. médiév. antimonium, probablt de l'ar. 'itmid, gr. stimmi ou stibi « noir d'antimoine »
♦ Chim. Corps simple (symb. Sb; no at. 51; m. at. 121,76), solide blanc argenté, cassant, dont le principal minerai est la stibine, et qui augmente la dureté des métaux auxquels on l'associe. ⇒ régule. Oxydes, sulfures, chlorures d'antimoine. ⇒ kermès, khôl, stibine, valentinite.
● antimoine nom masculin (bas latin antimonium, peut-être de l'arabe itmid) Corps solide, qui se rapproche beaucoup de l'arsenic. (Élément chimique de symbole Sb.) Numéro atomique : 51 Masse atomique : 121,75 Température de fusion : environ 630 °C Masse volumique : 6,6 g°cm3
antimoine
n. m. CHIM élément (symbole Sb) de numéro atomique Z = 51.
— Métalloïde (Sb) d'un blanc bleuâtre, ni malléable ni ductile, surtout rencontré sous forme de stibine (sulfure d'antimoine), qui durcit les métaux auxquels on l'allie.
⇒ANTIMOINE, subst. masc.
A.— CHIM. Corps simple, solide (symbole Sb) d'un blanc argenté et bleuâtre, cristallin, très fragile, ni malléable, ni ductile, présentant à la fois des propriétés de métal et de métalloïde, et entrant dans la composition de nombreux alliages et de différentes préparations pharmaceutiques :
• 1. On trouve l'antimoine, que les naturels désignent sous le nom de Batou-Tjilla, dans le lit des rivières. Si le prix en était plus élevé on pourrait en charger des navires. Depuis deux ans, la ville de Sadong a pris une très grande importance, grâce à l'exploitation de l'antimoine. [Bornéo].
DUMONT D'URVILLE, Voyage au Pôle Sud, t. 7, 1844, p. 137.
B.— MÉD. Agent thérapeutique très employé qui a donné lieu à de nombreuses querelles à partir du XVIIe s. :
• 2. (...) Il est d'autres métaux
Et l'antimoine, enfin, utile aux animaux,
Proscrit par des arrêts, ordonné par nos maux,
Et qui, de vains débats source longtemps féconde,
Avant de le guérir, scandalisa le monde ...
DELILLE, Les Trois règnes de la nature, 1808, p. 8.
• 3. ... c'est ainsi qu'on a vu, à des époques différentes, les cabales exalter Pradon et dénigrer Racine; s'élever contre l'antimoine et préconiser le système de Law; poursuivre Voltaire et canoniser le diacre Pâris : ...
JOUY, L'Hermite de la Chaussée d'Antin, t. 2, 1812, p. 193.
C.— MÉTALL. Corps entrant dans la composition de différents alliages et servant, p. ex., à bronzer les métaux (baume d'antimoine), à les durcir (antimonickel) :
• 4. L'alliage des métaux qui sert à la fonte des caractères est toujours le même : plomb, antimoine ou régule et étain...
E. LECLERC, Nouv. manuel complet de typogr., 1932, p. 54.
D.— MODES. Poudre utilisée en Orient pour noircir le tour des yeux :
• 5. ... ils y trouvèrent des robes d'hyacinthe, des éponges, des grattoirs, des brosses, des parfums, et des poinçons à antimoine, pour se peindre les yeux; ...
FLAUBERT, Salammbô, t. 1, 1863, p. 44.
Rem. À noter également : 1. Antimonial, ale aux, adj. et subst. masc. [En parlant d'un médicament] Qui contient de l'antimoine. Remède antimonial, préparation antimoniale. Subst. (gén. au plur.). Médicament contre-stimulant dont le principe actif est l'antimoine. 2. Antimonieux, euse, adj. [Se dit de l'oxyde (Sb2 O3) ou de certains composés] Qui renferme de l'antimoine trivalent. Acide antimonieux.
PRONONC. :[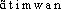 ]. — Antimonial. Dernière transcription ds DG : an-ti-mo-nyàl.
]. — Antimonial. Dernière transcription ds DG : an-ti-mo-nyàl.
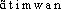 ]. — Antimonial. Dernière transcription ds DG : an-ti-mo-nyàl.
]. — Antimonial. Dernière transcription ds DG : an-ti-mo-nyàl. ÉTYMOL. ET HIST.
I.— Antimoine, début XIVe s. (Antidotaire Nicolas ds QUEM. sans attest.); XVe s. entimoine (La Turbe des philos. ds DG); av. 1590 antimoine (PARÉ, XXIV, ch. compl. ds LITTRÉ : Lorsque l'antimoine est calciné ou bruslé, qu'aucuns appellent préparé, il est rendu plus sec et plus dur).
II.— Antimonial, 1612 eau antimoniale (DELB., Rec. ds DG); av. 1672 les antimoniaux, dans la querelle de l'antimoine, nom par lequel on désigne les partisans de l'emploi de cette substance en méd. (GUI PATIN, Lettres, II, p. 137 ds LITTRÉ : M. Merlet dit que ce sont les antimoniaux de notre faculté [faculté de médecine] qui en ont payé l'impression [d'un pamphlet]).
III.— Antimonieux, 1838 (Ac. Compl. 1842).
I empr. au lat. médiév. antimonium attesté au XIe s. (1020-1087 CONSTANTINUS AFRICANUS, medicus, Grad., 381, 37 ds Mittellat. W. s.v., 710, 51); peut-être adaptation de l'ar.  « id. », var.
« id. », var.  (H. LAMMENS, Remarques sur les mots fr. dér. de l'ar., Beyrouth 1890, 260; LOK. 918; COR., s.v. antimonio). II empr. au lat. médiév. antimonialis attesté au même sens aux XIIe-XIIIe s. : ARTEPHIUS, (alchemista arabs), Secret., p. 13 ds Mittellat. W. s.v. III dér. du rad. du lat. antimonium (v. antimoine); suff. -eux.
(H. LAMMENS, Remarques sur les mots fr. dér. de l'ar., Beyrouth 1890, 260; LOK. 918; COR., s.v. antimonio). II empr. au lat. médiév. antimonialis attesté au même sens aux XIIe-XIIIe s. : ARTEPHIUS, (alchemista arabs), Secret., p. 13 ds Mittellat. W. s.v. III dér. du rad. du lat. antimonium (v. antimoine); suff. -eux.
 « id. », var.
« id. », var.  (H. LAMMENS, Remarques sur les mots fr. dér. de l'ar., Beyrouth 1890, 260; LOK. 918; COR., s.v. antimonio). II empr. au lat. médiév. antimonialis attesté au même sens aux XIIe-XIIIe s. : ARTEPHIUS, (alchemista arabs), Secret., p. 13 ds Mittellat. W. s.v. III dér. du rad. du lat. antimonium (v. antimoine); suff. -eux.
(H. LAMMENS, Remarques sur les mots fr. dér. de l'ar., Beyrouth 1890, 260; LOK. 918; COR., s.v. antimonio). II empr. au lat. médiév. antimonialis attesté au même sens aux XIIe-XIIIe s. : ARTEPHIUS, (alchemista arabs), Secret., p. 13 ds Mittellat. W. s.v. III dér. du rad. du lat. antimonium (v. antimoine); suff. -eux.STAT. — Fréq. abs. littér. :27.
BBG. — ALEX. 1768. — Antimoine = anti-moine? Vie Lang. 1952, p. 323. — BADER-TH. 1962. — Bible 1912. — BOUILLET 1859 (et s.v. antimonial, antimonieux). — BRARD 1838. — CHARLES 1960. — CHESN. 1857 (et s.v. antimonieux). — COLAS-CAB. 1968. — Comm. t. 1 1837. — COMTE-PERN. 1963. — Cost. 1899. — Courrier des lecteurs. Vie Lang. 1954, pp. 278-279. — DAIRE 1759. — DUVAL 1959 (et s.v. antimonial, antimonieux). — Électron. 1963-64. — FROMH.-KING 1968. — GALIANA Déc. sc. 1968. — GAY t. 1 1967 [1887]. — GRAND. 1962 (et s.v. antimonieux). — Lar. comm. 1930. — Lar. méd. 1970. — LITTRÉ-ROBIN 1865 (et s.v. antimonial, antimonieux). — MARCEL 1938. — Méd. Biol. t. 1 1970 (et s.v. antimonial, antimonieux). — Nucl. 1964. — NYSTEN 1824 (et s.v. antimonial, antimonieux). — PAMART (P.). De l'alchimie à la chimie. Vie Lang. 1969, n° 204, p. 138. — PRIVAT-FOC. 1870 (et s.v. antimonial, antimonieux). — Sc. 1962. — ST-EDME t. 1 1824. — UV.-CHAPMAN 1956.
antimoine [ɑ̃timwan] n. m.
ÉTYM. XIIIe; du lat. médiéval antimonium, probablt de l'arabe (’)ǐtmǐd, p.-ê. du grec stimmi ou stibi « noir d'antimoine ».
❖
♦ Chim. Corps simple (no at. 51; masse at. 121,76; symb. Sb), intermédiaire entre les métaux et les métalloïdes, cassant, argenté, dont le principal minerai est la stibine et qui augmente la dureté des métaux auxquels on l'associe (⇒ 1. Régule). || Oxydes d'antimoine : ⇒ Sénarmontite, valentinite. || Antimoine cru ou sulfure d'antimoine dit (vx) beurre d'antimoine (⇒ Kermès, khôl). || L'antimoine entre dans la composition de certains alliages (⇒ Antifriction, antimoniure); il est employé avec le plomb et l'étain dans la fabrication des caractères d'imprimerie.
0 Pour la tunique de la Diane, un ton de reflet analogue à celui de sa chair dans l'ombre : Antimoine, cadmium, etc.
E. Delacroix, Journal 1823-1850, 10 juin 1850.
❖
DÉR. V. Antimonial, antimoniate, antimonié, antimonieux, antimoniure.
Encyclopédie Universelle. 2012.