- МЕЖАТОМНОЕ ВЗАИМОДЕЙСТВИЕ
-
взаимодействие между атомами как свободными, так и входящими в состав одной или разных молекул, кристаллов и т. д. М. в. может быть к о в а л е н т н ы м, и о н н ы м, м е т а л л и ч е с к и м, типа в о д о р о д н о й с в я з и и в а н-д е р - в а а л ь с о в ы м. Первые три типа М. в. явл. причиной образования химических связей в молекулах, атомных и ионных кристаллах, металлах и сплавах; водородные связи могут образовываться внутри молекул и между разными молекулами в случае, когда между двумя электроотрицат. атомами располагается злектроположит. атом Н; ван-дер-ваальсовы М. в. обусловливают межмолекулярное взаимодействие, а также ответственны за нек-рые св-ва молекул (напр., за существование разл. конформеров; (см. ИЗОМЕРИЯ МОЛЕКУЛ)). Энергия ковалентного, ионного и металлич. М. в. =102 кДж/моль, энергия водородной связи =10—50 кДж/молъ и энергия ван-дер-ваальсова М. в. =0,1—1 кДж/моль.Помимо указанной классификации, М. в. часто делят на валентные и невалентные. К валентным М. в. относят ковалентные, ионные и металлические, а к невалентным — ван-дер-ваальсовы М. в. Вз-ствие типа водородной связи считают либо слабым валентным, либо занимающим промежуточное положение между валентным и невалентным М. в. Невалентное М. в. может включать не только чисто ван-дер-ваальсово притяжение и отталкивание атомов, но также индукционное и поляризационное, электростатич. и др. М. в. Энергия невалентного М. в. по крайней мере на два порядка меньше энергии валентного М. в.Ковалентное М. в. возникает в результате обобществления валентных эл-нов парой соседних атомов. Понижение энергии в этом случае выражается в обменных интегралах, поэтому Ковалентное межатомное взаимодействие часто называют обменным (см. ОБМЕННОЕ ВЗАИМОДЕЙСТВИЕ). Ковалентное М. в. является причиной существования молекул простых газов (Н2, Сl2 и пр.), разл. соединений (Н2O, NH3 и пр.), многочисл. органич. молекул (СН4, Н3С—СН3 и пр.), а также атомных кристаллов (различных модификаций фосфора и серы, графита и пр.).Ионное М. в. обусловлено переносом валентных эл-нов с одного атома на другой и электростатич. вз-ствием образовавшихся в результате этого переноса ионов. Оно характерно для соединений металлов с наиболее типичными металлоидами (напр., NaCl, СаСl2, Аl2O3), а также для ионных кристаллов (NaCl, CsCl и пр.). М. в. в ионных молекулах и кристаллах чаще всего носит частично ковалентный характер. Так, согласно квантовомеханич. расчётам, в молекуле Na+ Cl-заряды на атомах Na и Сl равны не заряду эл-на е, а составляют 0,8 е, и определённый вклад в стабилизацию этой молекулы вносит и обменное вз-ствие.Металлическое М. в. характерно для чистых металлов и их соединений между собой и связано с наличием эл-нов проводимости, свободно движущихся в решётке металла. Эти эл-ны электростатически взаимодействуют с положительно заряженными атомами металлов, скрепляя их между собой. Металлич. М. в., в отличие от ковалентного и ионного М. в., явл. нелокализованными и ненаправленными.Водородная связь возникает в том случае, когда между электроотрицат. атомами (атомами, обладающими большим сродством к эл-ну, напр. О, N, F) находится атом Н. Эл-н в атоме Н слабо связан с протоном, поэтому электронная плотность смещается на более электроотрицат. атом. В результате протон «оголяется» и не препятствует сближению атомов О...О, O...N и т. д., расстояние между к-рыми становится близким к тому, к-рое установилось бы в отсутствие атома Н.Ван-дер-ваальсово М. в. складывается из отталкивания атомов, обусловленного перекрыванием их электронных оболочек, и дисперсионного притяжения. При сближении атомов эл-ны, имеющие противоположно направленные спины, отталкиваются. В результате межэлектронного отталкивания электронная плотность в пр-ве между ядрами двух взаимодействующих атомов уменьшается, что приводит к увеличению энергии межъядерного отталкивания. Т. о., ван-дер-ваальсово отталкивание атомов при их сближении складывается из отталкивания эл-нов и электростатич. отталкивания ядер, дезэкранированных вследствие вз-ствия эл-нов. Дисперсионное притяжение атомов возникает в результате корреляции в движении эл-нов и явл. чисто квант. эффектом. Ван-дер-ваальсово М. в. ответственно за отклонение св-в реальных газов от св-в идеальных газов, за относит. стабильность разл. конформеров, за структуру и св-ва мол. кристаллов и жидкостей и т. д.М. в. определяется распределением электронной плотности в системе атомов и полностью описывается Шредингера уравнением. Для системы двух атомов решение ур-ния Шредингера, учитывающего кулоновское притяжение эл-нов к ядрам, межэлектронное и межъядерное отталкивание, а также кинетич. энергию эл-нов при разл. межъядерных расстояниях, даёт зависимость потенциальной энергии М. в. от расстояния между атомами. Точное решение получено только для мол. иона H+2. Для систем, состоящих из двух атомов, разработаны разл. приближённые методы решения ур-ния Шредингера. В случае же вз-ствия атомов в многоатомных молекулах или атомов, принадлежащих разным молекулам, применяются феноменологич. методы расчёта, базирующиеся на представлениях о точечных атомах. В основе этих методов лежит т. н. приближение Борна — Оппенгеймера, согласно к-рому энергию молекулы (и вообще любой многоатомной системы) можно рассматривать как непрерывную ф-цию координат ат. ядер.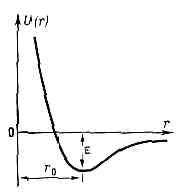 Зависимость потенциальной энергии межатомного вз-ствия U(r) от межъядерного расстояния r. e — глубина потенциальной ямы, r0 — равновесное межатомное расстояние.Для пары атомов такая ф-ция представлена на рис. Устойчивое состояние этой пары возникает при сближении атомов на определённое расстояние r0, отвечающее минимуму потенциальной энергии М. в. Р а в н о в е с н о е р а с с т о я н и е r0 и глубина потенциальной ямы e различны для разных типов М. в. Определение потенциальной энергии U(r) эффективного вз-ствия атомов по существу и есть задача определения М. в. Феноменологич. методы расчёта М. в. основаны на использовании разл. полуэмпирич. ф-л для U(r), в к-рые r0, e и нек-рые др. величины входят как параметры и подбираются на основании эксперим. данных.Ковалентное М. в. наиболее часто описывают потенциальной ф-цией Морзе (трёхпараметровым потенциалом Морзе):U(r)=e(1-ехр(-а(r-r0)))2, (1)где r0 примерно равно сумме ковалентных атомных радиусов, а величина а характеризует крутизну потенциальной ямы. Для двухатомной молекулы глубина потенциальной ямы e равна энергии диссоциации, а r0 — межъядерное расстояние, к-рое наблюдалось бы в отсутствии внутримол. колебаний и отличалось бы от межъядерного расстояния, усреднённого за время колебаний, не более чем на 0,001 нм.Потенциальную энергию ионного М. в. обычно записывают в виде:
Зависимость потенциальной энергии межатомного вз-ствия U(r) от межъядерного расстояния r. e — глубина потенциальной ямы, r0 — равновесное межатомное расстояние.Для пары атомов такая ф-ция представлена на рис. Устойчивое состояние этой пары возникает при сближении атомов на определённое расстояние r0, отвечающее минимуму потенциальной энергии М. в. Р а в н о в е с н о е р а с с т о я н и е r0 и глубина потенциальной ямы e различны для разных типов М. в. Определение потенциальной энергии U(r) эффективного вз-ствия атомов по существу и есть задача определения М. в. Феноменологич. методы расчёта М. в. основаны на использовании разл. полуэмпирич. ф-л для U(r), в к-рые r0, e и нек-рые др. величины входят как параметры и подбираются на основании эксперим. данных.Ковалентное М. в. наиболее часто описывают потенциальной ф-цией Морзе (трёхпараметровым потенциалом Морзе):U(r)=e(1-ехр(-а(r-r0)))2, (1)где r0 примерно равно сумме ковалентных атомных радиусов, а величина а характеризует крутизну потенциальной ямы. Для двухатомной молекулы глубина потенциальной ямы e равна энергии диссоциации, а r0 — межъядерное расстояние, к-рое наблюдалось бы в отсутствии внутримол. колебаний и отличалось бы от межъядерного расстояния, усреднённого за время колебаний, не более чем на 0,001 нм.Потенциальную энергию ионного М. в. обычно записывают в виде: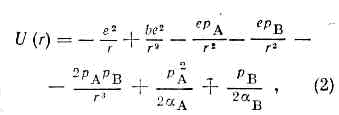 где рA и рB — дипольные моменты ионов, aА и aB — их поляризуемости, — эмпирич. константа. Первый член (2) учитывает энергию кулоновского притяжения разноимённо заряженных ионов, второй — энергию обменного отталкивания электронных оболочек, третий и четвёртый члены характеризуют энергию вз-ствия свободных зарядов ионов с диполями PА PB, образовавшимися в результате поляризации каждого иона в электрич. поле др. иона, пятый — вз-ствие этих диполей друг с другом, шестой и седьмой — энергию деформации диполей квазиупругом приближении). Глупа потенциальной ямы равна:
где рA и рB — дипольные моменты ионов, aА и aB — их поляризуемости, — эмпирич. константа. Первый член (2) учитывает энергию кулоновского притяжения разноимённо заряженных ионов, второй — энергию обменного отталкивания электронных оболочек, третий и четвёртый члены характеризуют энергию вз-ствия свободных зарядов ионов с диполями PА PB, образовавшимися в результате поляризации каждого иона в электрич. поле др. иона, пятый — вз-ствие этих диполей друг с другом, шестой и седьмой — энергию деформации диполей квазиупругом приближении). Глупа потенциальной ямы равна: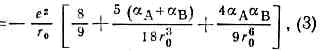 равновесное расстояние r0 определяли ур-нием:
равновесное расстояние r0 определяли ур-нием: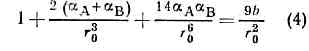 и равно сумме ионных радиусов атомов.Ионное M. в. определяет структуру энергетику ионных кристаллов.Для детального описания их структуры используют ф-лу (4), однако для оценки межатомных расстояний с умеренной точностью применяют аддитивную схему, основанную на системе ионных радиусов.Металлич. М. в. иногда описывают модифициров. кулоновским потенциалом (наз. псевдопотенциалом), эффективно учитывающим вз-ствие эл-нов с оболочкой ионов, с обрезанием на малых расстояниях:
и равно сумме ионных радиусов атомов.Ионное M. в. определяет структуру энергетику ионных кристаллов.Для детального описания их структуры используют ф-лу (4), однако для оценки межатомных расстояний с умеренной точностью применяют аддитивную схему, основанную на системе ионных радиусов.Металлич. М. в. иногда описывают модифициров. кулоновским потенциалом (наз. псевдопотенциалом), эффективно учитывающим вз-ствие эл-нов с оболочкой ионов, с обрезанием на малых расстояниях: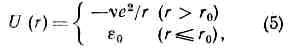 где v — заряд иона, равный числу эл-нов проводимости, приходящихся на один ион металла, e0 и r0 — параметры обрезания.Для водородных связей вводят спец. потенциалы, гл. параметрами к-рых явл. r0 и e, напр. используют ф-лу (1). Угловая же зависимость энергии водородной связи управляется ван-дер-ваальсовыми М. в., описываемыми атом-атомными потенциальными ф-циями (см. ниже). Так, угол О — Н...О, напр., не может быть острым, поскольку в этом случае энергия ван-дер-ваальсова М. в. была бы слишком высокой.Ван-дер-ваальсово М. в. описывают ф-лой Леннард-Джонса (потенциалом 6—12 Леннард-Джонса):U (x) = e(x-12 -2x-6), (6)где x=r/r0, или ф-лой Букингема (трёхпараметровым потенциалом Букингема 6-ехр):U(x)=- Ax-6 + Bexp(-Cxr0), (7)где А, В к С — эмпирич. параметры.Расстояние r0 в случае ван-дер-ваальсова М. в. обычно на 0,2—0,3 нм больше, а глубина потенциальной ямы e меньше на 3—4 порядка, чем при валентном М. в. Невалентное М. в. приближённо характеризуется ван-дер-ваальсовыми радиусами, к-рые примерно на 0,1 нм больше ковалентных радиусов. Сумма ван-дер-ваальсовых радиусов соответствует мин. расстоянию, на к-рое атомы могут сблизиться при нормальных условиях. Если r0 для ковалентного М. в. с хорошей точностью равно сумме ковалентных радиусов атомов, то значение r0 в ф-лах (6) и (7) больше суммы ван-дер-ваальсовых радиусов (превышение может достигать 0,1 нм).Система ван-дер-ваальсовых радиусов, возникшая на основе многочисл. эксперим. данных, позволяет определять форму молекулы, если известны длины связей, валентные и двугранные углы (см. МОЛЕКУЛА). Знание ван-дер-ваальсового «окаймления» молекул очень полезно при изучении структуры мол. кристаллов, а также жидкостей на основе принципа плотной упаковки молекул.Более точное теор. изучение структуры мол. кристаллов и жидкостей проводят с помощью метода а т о м-а т о м н ы х п о т е н ц и а л ь н ы х ф-ц и й. В его основе лежит предположение о том, что энергия кристалла представляет собой сумму энергий вз-ствня пар молекул, а энергия вз-ствия каждой пары молекул складывается из ван-дер-ваальсовых М. в., описываемых потенциальными ф-циями (6) или (7). Такой метод оказывается эффективным для исследования органич. кристаллов, построенных из атомов трёх-четырёх сортов. Так, зная эмпирич. константы e и r0 в выражении (6) или константы А, В, С в выражении (7), описывающих потенциальную энергию вз-ствия атомов С...С и Н...Н, можно рассчитать структуру и термодинамические свойства многочисл. кристаллов углеводородов.Метод атом-атомных потенциальных ф-ций применяется и для расчётов конформаций (чаще всего в гибких органич. молекулах, в к-рых вращения вокруг хим. связей сравнительно свободны). Минимизируя энергию молекулы по внутр. геом. параметрам (в частности, по углам вращения), находят равновесную конформацию. Применение метода атом-атомных потенциальных ф-ций в сочетании с рентгеновским структурным анализом привело к увеличению точности и надёжности определения структурных параметров нек-рых белков, полисахаридов, ДНК и транспортных РНК.Наряду с феноменологич. методами, играющими важную роль в разл. приложениях, в изучении М. в. применяются методы решения многоэлектронной задачи для многоатомной молекулы или для двух взаимодействующих молекул (см. КВАНТОВАЯ ХИМИЯ). Подавляющее большинство таких методов основано на приближении самосогласованного поля. Неэмпирич. расчёты, проводимые на ЭВМ, позволяют получать всё большую информацию о М. в.
где v — заряд иона, равный числу эл-нов проводимости, приходящихся на один ион металла, e0 и r0 — параметры обрезания.Для водородных связей вводят спец. потенциалы, гл. параметрами к-рых явл. r0 и e, напр. используют ф-лу (1). Угловая же зависимость энергии водородной связи управляется ван-дер-ваальсовыми М. в., описываемыми атом-атомными потенциальными ф-циями (см. ниже). Так, угол О — Н...О, напр., не может быть острым, поскольку в этом случае энергия ван-дер-ваальсова М. в. была бы слишком высокой.Ван-дер-ваальсово М. в. описывают ф-лой Леннард-Джонса (потенциалом 6—12 Леннард-Джонса):U (x) = e(x-12 -2x-6), (6)где x=r/r0, или ф-лой Букингема (трёхпараметровым потенциалом Букингема 6-ехр):U(x)=- Ax-6 + Bexp(-Cxr0), (7)где А, В к С — эмпирич. параметры.Расстояние r0 в случае ван-дер-ваальсова М. в. обычно на 0,2—0,3 нм больше, а глубина потенциальной ямы e меньше на 3—4 порядка, чем при валентном М. в. Невалентное М. в. приближённо характеризуется ван-дер-ваальсовыми радиусами, к-рые примерно на 0,1 нм больше ковалентных радиусов. Сумма ван-дер-ваальсовых радиусов соответствует мин. расстоянию, на к-рое атомы могут сблизиться при нормальных условиях. Если r0 для ковалентного М. в. с хорошей точностью равно сумме ковалентных радиусов атомов, то значение r0 в ф-лах (6) и (7) больше суммы ван-дер-ваальсовых радиусов (превышение может достигать 0,1 нм).Система ван-дер-ваальсовых радиусов, возникшая на основе многочисл. эксперим. данных, позволяет определять форму молекулы, если известны длины связей, валентные и двугранные углы (см. МОЛЕКУЛА). Знание ван-дер-ваальсового «окаймления» молекул очень полезно при изучении структуры мол. кристаллов, а также жидкостей на основе принципа плотной упаковки молекул.Более точное теор. изучение структуры мол. кристаллов и жидкостей проводят с помощью метода а т о м-а т о м н ы х п о т е н ц и а л ь н ы х ф-ц и й. В его основе лежит предположение о том, что энергия кристалла представляет собой сумму энергий вз-ствня пар молекул, а энергия вз-ствия каждой пары молекул складывается из ван-дер-ваальсовых М. в., описываемых потенциальными ф-циями (6) или (7). Такой метод оказывается эффективным для исследования органич. кристаллов, построенных из атомов трёх-четырёх сортов. Так, зная эмпирич. константы e и r0 в выражении (6) или константы А, В, С в выражении (7), описывающих потенциальную энергию вз-ствия атомов С...С и Н...Н, можно рассчитать структуру и термодинамические свойства многочисл. кристаллов углеводородов.Метод атом-атомных потенциальных ф-ций применяется и для расчётов конформаций (чаще всего в гибких органич. молекулах, в к-рых вращения вокруг хим. связей сравнительно свободны). Минимизируя энергию молекулы по внутр. геом. параметрам (в частности, по углам вращения), находят равновесную конформацию. Применение метода атом-атомных потенциальных ф-ций в сочетании с рентгеновским структурным анализом привело к увеличению точности и надёжности определения структурных параметров нек-рых белков, полисахаридов, ДНК и транспортных РНК.Наряду с феноменологич. методами, играющими важную роль в разл. приложениях, в изучении М. в. применяются методы решения многоэлектронной задачи для многоатомной молекулы или для двух взаимодействующих молекул (см. КВАНТОВАЯ ХИМИЯ). Подавляющее большинство таких методов основано на приближении самосогласованного поля. Неэмпирич. расчёты, проводимые на ЭВМ, позволяют получать всё большую информацию о М. в.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- МЕЖАТОМНОЕ ВЗАИМОДЕЙСТВИЕ
-
- взаимодействие атомов, находящихся в одинаковых либо в различных энергетич. и зарядовых состояниях. M. в. характеризуется потенциальной энергией (потенциалом взаимодействия) F, зависящей от взаимного расположения взаимодействующих атомов, в особенности от расстояния r между их ядрами. При определ. равновесном расстоянии r0 и не слишком больших кинетич. энергиях свободных атомов в результате M. в. может возникнуть более или менее стабильная хим. связь между атомами, прочность к-рой зависит от вида атомов; её мерой могут служить время жизни молекулы, а также энергия хим. связи.
Наиб, простой случай M. в.- упругое столкновение атомов идеальных газов, к-рое в данной статье рассматриваться не будет (см. Столкновения атомные). В др. случаях M. в. неоднозначно ввиду многообразия условий, в к-рых могут оказаться атомы. Их внутр. энергия может измениться на десятки эВ только за счёт внеш. воздействий, к-рые способны воспринять и сохранить на какое-то время внеш. электронные оболочки атомов; неск. порядков величины занимает диапазон газокннетических и поперечных сечений других, более сложных процессов, различны симметрия и пространств, ориентация электронных плотностей их оболочек. Все эти характеристики атомов непосредственно определяют M. в.
M. в. связано в осн. с эл.-статич. и эл.-магн. силами, действующими между атомами. Количественная квантовая теория M. в. потребовала, кроме того, учёта принципа Паули. T. о., M. в. определяется взаимным расположением и перемещением взаимодействующих атомов и их фрагментов (электронов или распределённых в пространстве электронных оболочек и самих ядер).
Различают химические (или валентные) и физические (невалентные) M. в. К первым относят ковалентные (или гомополярные, обменные или донорно-акцептор-ные), ионные (или гетерополярные) и металлические M. в. Ко вторым - ван-дер-ваальсовы M. в., включающие эл.-статич. взаимодействия мультиполей, поляризационные (индукционные и дисперсионные), релятивистские магн. и запаздывающие эл.-магн. M. в. По энергетич. и пространств, характеристикам, промежуточным между валентным и невалентным M. в., является M. в., наз. водородной связью. Хим. связи более чем на порядок сильнее физических (соответственно единицы - десятки эВ и десятые доли - единицы эВ). M. в. возбуждённых атомов может приводить к образованию короткоживущих возбуждённых молекул (эксимерных молекул). Это пример сильной (~5 эВ), но не прочной, вернее не долгой, связи. Такого типа M. в. иногда носят резонансный характер.
Обычно конкретное M. в. включает в себя в разной степени разл. типы M. в., причём относит, вклад каждого M. в. не всегда удаётся установить; это может быть связано с близкими для них зависимостями V от r, напр, для неск. видов M. в. на больших расстояниях V~ r-6. Нек-рые из физ. M. в. более характерны для межмолекулярных взаимодействий.
Химические M. в. Ковалентное M. в. имеет направленный, локализованный и насыщенный характер. При образовании хим. ковалентной связи происходят обобществление и концентрирование пары электронов на молекулярной орбитали, к-рая имеет пространств. фиксацию относительно связывающихся атомов. В образованной общей орбитали обобществлённые электроны могли первоначально принадлежать обоим атомам (образование H2, N2, O2 и др.) либо, при возникновении донорно-акцепторной связи, только одному из атомов - донору, свободная же орбиталь принадлежит второму атому - акцептору. В качестве доноров или акцепторов могут служить целые группы атомов. Молекулы с ковалентной связью обычно полярные, т. е. имеют пост, электрич. дипольный момент.
В результате обработки разл. рода экспериментов и прямых квантовомеханич. расчётов оказалось, что потенциал ковалентных M. в. можно представить в виде
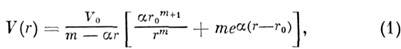
где подгоночные параметры
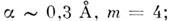 координаты минимума потенциала V0 и r0 определяются конкретными взаимодействующими атомами. Первое слагаемое в (1) связано с притяжением, второе - с отталкиванием [В. Гайтлер (W. Heitler) и Ф. Лондон (F. London), 1927].
координаты минимума потенциала V0 и r0 определяются конкретными взаимодействующими атомами. Первое слагаемое в (1) связано с притяжением, второе - с отталкиванием [В. Гайтлер (W. Heitler) и Ф. Лондон (F. London), 1927].Ионное M.в. вызвано смещением валентных электронов одного атома (аниона) к другому (катиону), между к-рыми возникает эл.-статич. притяжение. Примеры ионных связей - M. в. в галогенидах щелочных металлов. Эти связи нслокализованные и ненасыщаемые. Потенциал ионного M. в. определяется ф-лой
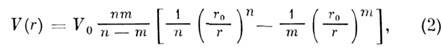
где n= 6-9, т =1; остальные подгоночные параметры зависят от взаимодействующих атомов. T. к. чисто ионного или ковалентного M. в. не существует, для оценки ионной составляющей в ионно-ковалентной связи вводят параметр электроотрицательность атомов элементов, к-рый определяется полусуммой потенциала ионизации и сродства к электрону. Разность электроот-рицательностой взаимодействующих атомов примерно равна доле ионной составляющей в M. в.
Металлическое M. в. отличается нелокализованностью, ненасыщаемостью и ненаправленностью связей и определяется взаимодействием обобществлённого электронного газа с ионным остовом крнсталлич. структуры. Наиб, выражены M. в. этого типа в кристаллах металлов и сплавов. Потенциал металлич. M. в. определяется выражением
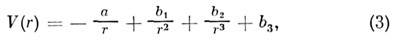
где a, b1 , b2 , b3 - подгоночные параметры, характеризующие конкретное M. в.
Физические (ван-дер-ваальсовы) M. в. целиком описывают взаимодействие атомов благородных газов, нек-рых органич. соединений и, кроме того, вносят вклад во взаимодействия др. типов. Электрич. взаимодействие мультиполей приводит к т. н. ориентацией н о м у взаимодействию, описываемому ф-лой
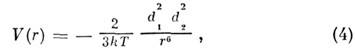
где d1 , d2- дипольные моменты взаимодействующих частиц. M. в. не ограничивается взаимодействием лишь диполей.
Однако M. в. с участием квадруполей и мультиполей более высокого порядка малы и обычно ими можно пренебречь (они характерны для межмолекулярного взаимодействия). Примеры взаимодействия мультиполей - M. в. с участием возбуждённых атомов и молекул.
Поляризационное M.в. возникает при поляризац. смещении электронных оболочек взаимодействующих атомов; такие M. в. можно рассматривать как ослабленную форму чисто ионной связи. Поляризац. M. в. подразделяются на индукционные и дисперсионные. Индукц. энергия взаимодействия атомов в осн. состоянии всегда отвечает притяжению, а в возбуждённых электронных состояниях возможны и притяжение, и отталкивание; она определяется ф-лой Дебая - Фалькенхагена
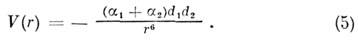
Дисперсионная энергия возникает благодаря чисто квантовомеханич. флуктуациям электронной плотности, не имеющим классич. аналога [Уонг (Wong), 1927]. F. Лондон (1930) дал общую теорию дисперсионных сил, объяснившую притяжение между атомами благородных газов и отталкивание на коротких расстояниях. Ф-ла для дисперсионного M. в. получается из решения ур-ния Шрёдингера методом теории возмущений:
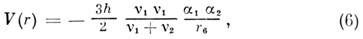
где v1 , v2 - характеристич. частоты возбуждения взаимодействующих атомов. Для сферически-симметричных систем поляризац. энергия определяется статич. поляризуемостями атомов, а дисперсионная - дина-мич. поляризуемости или силами осцилляторов квантовых переходов.
Релятивистские магнитные и запаздывающие электромагнитные M. в. необходимо учитывать на больших расстояниях между атомами. Вклады этого типа M. в. увеличиваются с ростом массы атомов и при их возбуждении (т. е. при увеличении их размеров и внутр. энергии). Прямой расчёт показывает, что M. в. магн. типа становятся заметными на расстояниях ~ (10-100)r Б (r Б - радиус Бора) даже для атомов гелия. Механизм проявления эл.-магн. запаздывания объясняется рассогласованием взаимной ориентации диполей за время распространения взаимодействия.
Учёт спиновых взаимодействий, вызывающих сверхтонкое расщепление спектральных линий, также оказывается необходимым на больших расстояниях (для атомов водорода при r> 10r Б ).
Водородная связь может быть как внутримолекулярной, так и межмолекулярной. Диапазон энергии H-связей перекрывает весь энергетич. диапазон M. в. и делится на области сильных, средних и слабых H-связей. Они играют важную роль в биол. соединениях и MH. биохим. процессах. Особенность Н-свя-зи обусловлена тем, что благодаря малому радиусу (на порядок величины меньший, чем радиусы др. ионов) ион H+ способен попадать в небольшие области между атомами. Напр., связь между молекулами воды определяется через протоны, к-рые одновременно связаны с "собственным" кислородом ковалентной внутримолекулярной связью и с кислородом др. молекулы ионной межмолекулярной связью (рис. 1).
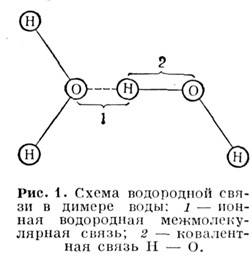
В табл. 1 приведены энергии связи и равновесные расстояния между атомами А и В, H и А при разл. типах M. в.
Экси мерные M. в. Атомы инертных газов (и нек-рых др. элементов, напр. Hg) в возбуждённом состоянии проявляют свойства, сходные со свойствами атомов щелочных металлов. В частности, они образуют эксимерные молекулы с временем жизни от 4*10-9 с (для ArF) до 4*10-6 с (для Ar2).
Табл. 1 .
Тип межатомного взаимодействия
Энергия взаимодействия, икал/моль
AB
НА
Ван-дер-ваальсово взаимодействие
0,01- 0,1
3-4
Н-связь:
слабая
0,1 - 1,0
3,0 - 3,5
2,0 - 2,5
средняя
5,0-15,0
2,7 - 3,0
1,7-2,0
сильная
20-00
2,2 - 2,5
1,1 - 1,2
Химическая связь
40 - 200
1 ,0 - 2,0
-
ния, включающие атомы галогенов, имеют энергии связи, близкие к соответствующим молекулам. В табл. 2 приведены равновесные расстояния г„ между атомами и энергии диссоциации D нек-рых эксимерных молекул и соответствующих им молекул галогенидов щелочных металлов.
Табл. 2.
Молекулы
D, эВ
Kr*F
2,27
5,54
RbF
2,27
5,80
Xe*F
2,49
5,30
CsF
2,35
5,66
Хе*Сl
2,94
4,53
CsCl
2,91
4,87
Хе*Вr
2,96
4,30
CsBr
3,07
4,71
Хе*I
3,31
4,08
CsI
3,35
4,39
T а б л. 3.
Система
V0 , мэB
H-He
0,46
3,6
H-Ne
2,82
3,18
H-Ar
4,80
3,56
H-Kr
6,08
3,70
H-Xe
6,81
3,95
Не- Не
0,93
2,965
Ne - Ne
3,62
3,102
Ar-Ar
12,10
3,76
Kr-Kr
17,00
4,03
Xe-Xe
24,20
4,36
В эксимерной молекуле Ar2F атомы связаны одновременно по ионному (фтор и возбуждённый аргон) ц по ковалентному (атомы аргона) типам хил. связи.
К эксимерным M. в. следует отнести и резонансные M. в. между одинаковыми атомами, один из к-рых возбужден и поэтому имеет деформированную электронную оболочку. Разнообразие M. в. обусловлено особенностями деформаций плотностей электронных оболочек взаимодействующих атомов. Большое число существующих разл. представлений потенциалов M. в. (только для упругих M. в. их имеется неск. десятков) лишь частично удовлетворяет практику, т. к. ни одна из предложенных ф-л не универсальна. Различные V(R )имеют зону применимости либо по типам атомов, либо по расстояниям между ними, либо они привязаны к определ. типу первичной эксперим. информации. Значения параметров V вычисляются методом подгонки, обеспечивающей наилучшее согласие с выбранной матем. моделью явления.
Одной из наиб, универсальных оказалась ф-ла модифициров. потенциала Данема:
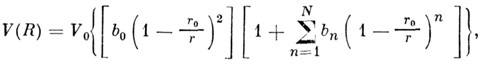
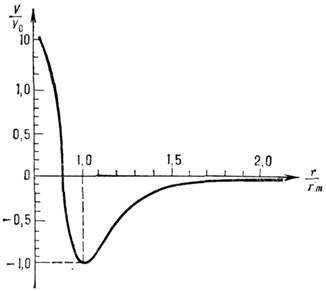
где V0 - глубина потенциальной ямы; r0 - равновесное значение г, соответствующее минимуму V; b0 , b п- подгоночные параметры. Имеется относительно большая устойчивость числовых значений V0 и r0. при переходе к разл. представлениям V. Затруднённость аналитич. аппроксимации V исё чаще вынуждает ограничиваться численным табличным или графич. представлением V= V(r), где ri - межатомное расстояние и др. координаты взаимного расположения взаимодействующих атомов. На рис. 2 представлен безразмерный потенциал M. в. одинаковых атомов благородных газов. В таких координатах прекрасно соблюдается закон соответственных состояний. В табл. 3 приведены значения V0 и r0 также и для разл. пар атомов. В реальных атомно-молекулярных образованиях принцип парной аддитивности, при к-рой потенциал M. в. равен сумме парных потенциалов всех участников M. в., строго не выполняется, т. к. заряды нельзя считать точечными, их плотность имеет непрерывное пространственно-временное распределение, возмущаемое внеш. и собств. полями. Этот принцип приблизительно выполняется лишь для модифициров. парных потенциалов. В этом случае берутся парные потенцна-лы не изолированных пар взаимодействующих объектов, а их потенциалы в условиях, максимально приближённых к исследуемым. Приближение парного аддитивного потенциала часто используют для оценочных расчётов. Так, на основе аналитпч. выражения для потенциала M. в. получены [Дж. К. Максвелл (J. С. Maxwell), Л. Больцман (L. Boltzmann)] явные выражения для коэф. диффузии, теплопроводности, вязкости (см. в ст. Газ), а позднее - коэф. вириальных разложений. Квантовомеханнч. расчёты реальных (наиб, простых) систем осуществлены с помощью адиабатич. приближения, учитывающего перемещение ядер (более медленное, чем движение электронов). Однако для M. в. атомов, быстро движущихся относительно друг друга, это приближение неприменимо. Адиабатич. приближение справедливо, когда время взаимодействия a/v (a- размер системы, v- скорость относит, перемещения атомов) много больше времени перехода между термами взаимодействующей системы (параметр Месси). На больших расстояниях при малых v для расчёта M. в. возбуждённых, ионизованных и др. систем иногда используют асимптотич. подход к решению ур-ния Шрёдингера.
Рис. 2. Безразмерный потенциал взаимодействия симметричных пар атомов благородных газов. Отклонения от закона соответственных состояний для различных атомов укладываются в различную ширину линии графика.
Долгое время полагали, что потенциал M. в. зависит лишь от расстояния между взаимодействующими частицами, т. е. размерами самих частиц и их взаимной ориентацией пренебрегали, атомы считали сферически-симметричными. В настоящее время вводятся в рассмотрение анизотропные потенциалы M. в., к-рые более актуальны для межмолекулярного взаимодействия, но играют также важную роль для M. в. гюляризов. атомов. На рис. 3 приведены зависимости от температуры второго вири-ального коэф., контролирующего характер M. в. для поляризованного и неполяризованного 3He.
Одно из проявлений анизотропии M. в.- образование молекул и кристаллов.
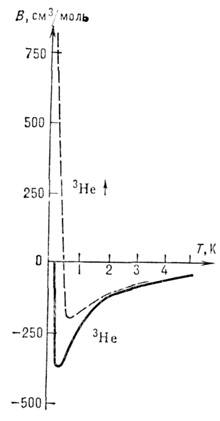
Рис. 3. Температурная зависимость второго вириального коэффициента В (см 3/моль) для поляризованного
 и неполярнзованного 3He.
и неполярнзованного 3He.При их вхождении в более сложные системы симметрия отдельных структурных единиц может сохраниться или измениться в зависимости от симметрии их положения в образованных ими молекулах и кристаллах. Эти вопросы разрешаются в соответствии с принципом Кюри и принципом минимума энергии нового образования. Потенциал V в простейших системах (атомы и ионы водорода и гелия) может быть определён из решения ур-ния Шрёдингера. В подавляющем большинстве случаев V находится путем решения т. н. обратных задач по экспериментально найденным величинам, непосредственно зависящим от V. Наиб, точные значения потенциалов получают с помощью эксперим. данных по рассеянию молекулярных и атомных пучков;значение F находят также с помощью эмпирически полученных вириальных коэффициентов, из спектросконич. данных, из нек-рых модельных расчётов.
Лит.:Torrens I. M., Interatomic potentials, N.Y.- L., 1972; Современная кристаллография, т. 2, M., 1979; Леонас В. Б., Межмолекулярные взаимодействия и столкновения атомов и молекул, в кн.: Итоги науки и техники. Серия Физика атома и молекулы. Оптика. Магнитный резонанс, т. 1, M., 1980; Fано У., Fано Л., Физика атомов и молекул, пер. с англ., M., 1980; Галицкий В. M., Никитин E. E., Смирнов Б. M., Теория столкновения атомных частиц, M., 1981; Смирнов Б. M., Возбужденные атомы, M., 1982; Лалоэ Ф. и др., Оптическая поляризация ядер гелия-3, "УФН", 1985, т. 147, в. 3, с. 433; Попов В. К., Мощные оксимерные лазеры и новые источники когерентного излучения в вакуумном ультрафиолете, там же, с. 587; Елецкий А. В., Смирно в Б. M., Физические процессы в газовых лазерах, M., 1986.
Ю. H. Любитов.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.