DEUTÉRIUM ET TRITIUM
Le deutérium est l’isotope de masse 2 de l’hydrogène. Son symbole chimique, 21H, est souvent désigné par la lettre D. Le deutérium a été découvert en 1931 par Harold C. Urey et ses collaborateurs, qui observèrent dans le spectre optique de l’hydrogène les raies de la série de Balmer correspondant au déplacement isotopique calculé pour la masse 2. Ces résultats furent confirmés l’année suivante par Walker Bleakney, qui observa directement le deutérium dans le spectre de masse de l’hydrogène. Le deutérium est stable et existe dans la nature.
Le tritium est l’isotope de masse 3 de l’hydrogène, 31H, souvent désigné par le symbole T. Son existence a été mise en évidence pour la première fois en 1934, par Ernest Rutherford et ses collaborateurs, dans la réaction nucléaire D + DT + p.
La molécule de deutérium
Comme l’hydrogène, le deutérium existe normalement à l’état de molécule diatomique; en présence d’hydrogène léger, il se produit un équilibre entre les trois combinaisons possibles pour les atomes 11H et 21H: H2 (molécule d’hydrogène ou de protium), D2 (molécule de deutérium) et HD (hydrure de deutérium). Cet équilibre est représenté par le schéma: H2 et D2 曆 2 HD. La masse de l’atome de deutérium est, dans l’échelle du 12C, de 2,0141020 u (1 u=1 unité de masse atomique = 1,6605655.10-27 kg).
Les constantes physiques du deutérium moléculaire sont très voisines de celles de l’hydrogène léger. Le point de liquéfaction à la pression normale est de 23,67 K (20,39 K pour l’hydrogène de masse 1). Comme pour l’hydrogène léger, il existe deux variétés de molécules de deutérium: l’orthodeutérium (molécule dont les deux spins nucléaires sont parallèles 糧糧) et le paradeutérium (couplage antiparallèle des spins 糧). Le spin nucléaire du deutérium étant 1 (1/2 dans le cas du protium), les proportions d’ortho- et de paradeutérium à l’équilibre, à différentes températures, sont très différentes de celles de l’hydrogène léger. Au zéro absolu, c’est l’orthodeutérium qui représente la seule variété possible à l’équilibre (variété para dans le cas de l’hydrogène de masse 1). Aux températures très élevées, le facteur statistique de répartition ortho-para est de 2 (3 dans le cas du protium).
L’oxyde de deutérium D2 O ou eau lourde
La substitution dans une molécule d’eau d’atomes d’hydrogène de masse 1 par des atomes de deutérium conduit à deux variétés d’eau lourde: l’oxyde de deutérium D2O et l’hydroxyde de deutérium HOD. Ces variétés sont à équilibre dans l’eau. La masse volumique de l’eau lourde est difficile à apprécier par des méthodes gravimétriques. Il existe en effet trois isotopes naturels de l’oxygène: 16O, 17O, 18O. Dans la nature 18O est sensiblement plus abondant par rapport à 16O (1618O = 489,3) que le deutérium par rapport à l’hydrogène léger (H/D = 6 400). Il existe 18 combinaisons isotopiques possibles pour une molécule d’eau. Les plus fréquentes sont: 1H216O, 1H218O, 1H217O, 2H216O, 1H2H16O. Les propriétés physiques de l’oxyde de deutérium sont quelque peu différentes de celles de l’eau légère; l’eau lourde bout à 101,4 0C et fond à 3,813 0C sous la pression normale. L’oxyde de deutérium est préparé industriellement en grandes quantités par électrolyse. Lors de l’électrolyse de l’eau, l’hydrogène léger se dégage beaucoup plus rapidement que l’hydrogène lourd et la concentration de l’électrolyte en D2O augmente rapidement. Suivant la nature de la cathode utilisée, le facteur d’enrichissement peut varier de 4 à 15. L’eau lourde est toxique pour les organismes évolués; une teneur supérieure à 30 p. 100 dans les tissus est mortelle.
Utilisation de l’eau lourde dans les réacteurs nucléaires
La principale application industrielle de l’eau lourde fut son emploi comme modérateur dans certains réacteurs nucléaires. Le ralentissement des neutrons émis lors de la fission du 235U est en effet maximal lorsque les collisions ont lieu sur des noyaux de même masse que le neutron, c’est-à-dire des protons (la masse du proton est pratiquement égale à celle du neutron). Cependant, dans le choix du modérateur, il est nécessaire de tenir compte des propriétés physiques des matériaux utilisés (densité, chaleur spécifique...), qui interviennent dans les problèmes d’évacuation de la chaleur, et de la capture des neutrons par les noyaux des atomes du ralentisseur (diminution du flux neutronique). L’eau naturelle possède, du point de vue de ses qualités modératrices, un très bon coefficient de diffusion: 靖 = 50 barns (1 barn = 10-28 m2); mais elle possède une forte section efficace d’absorption radiative ( 靖 = 0,33 barn), le neutron effectuant avec le proton, pour de faibles énergies incidentes, des réactions du type n + pd + 塚 (n: neutron; p: proton; d: deuton). L’eau lourde est alors préférée, bien que ses propriétés diffusantes soient sensiblement moins bonnes ( 靖 = 7,4 barns), en raison de sa très faible section efficace de capture: 靖 = 0,000 46 barn.
Le noyau de l’atome de deutérium ou deuton
Le noyau de deutérium possède un spin 1, ce qui signifie que les deux nucléons qui le composent (un proton et un neutron) ont couplé leurs spins parallèlement (état 3S1). Sa parité est positive, son moment dipolaire magnétique est égal à 0,857 393 magnéton nucléaire, son moment quadrupolaire électrique, Q = 0,002 82 barn, indique une ellipticité égale à 0,095, son diamètre enfin est de 0,8 fermi (1 fermi = 10-15 m). Le noyau de deutérium constitue le système nucléaire le plus simple (un proton et un neutron liés); il a fait l’objet de nombreuses études théoriques en vue d’obtenir des informations sur la force de liaison nucléaire. Le défaut de masse du deuton, ou énergie de liaison: M = M d 漣 (M p + M n), est égal à 2,225 6 梁 0,001 5 MeV. Si l’on suppose que la force nucléaire dérive d’un potentiel et que celui-ci ait la forme d’un puits carré:

(r représente la distance proton-neutron, D la profondeur du puits et b la portée des forces), on peut en mécanique quantique, en assimilant l’énergie totale à l’énergie de liaison, obtenir une relation entre la portée de la force nucléaire et la profondeur du puits qui rend compte des ordres de grandeurs observés. Cette relation fut un des premiers succès dans l’application de la mécanique quantique à la physique nucléaire. D’autres types de potentiels nucléaires ont pu être ainsi testés.
Le deuton est souvent utilisé en physique nucléaire comme projectile transmutant. Les réactions nucléaires induites comportent un mécanisme particulier (réactions de stripping ) dans lequel le noyau cible absorbe un des deux nucléons et diffuse l’autre [réactions (d,p) ou (d,n)]. Ces réactions donnent de précieux renseignements sur la structure nucléaire.
Le noyau de deutérium est associé aux principales réactions de fusion nucléaire:

Le deuton forme le premier maillon de la nucléosynthèse. Dans le Soleil, où la température atteint 107 K, la réaction:
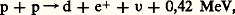
peut s’amorcer; elle représente le premier mécanisme dans l’évolution de l’astre.
Notons enfin que le deuton peut être formé dans la réaction de capture: n + pd + 塚, avec des neutrons de faible énergie, et détruit par irradiation aux rayons 塚 de haute énergie: dp + n (photodésintégration du deuton).
Le tritium
Luis W. Alvarez a démontré en 1939 que le tritium s’apparente chimiquement à l’hydrogène. Le tritium existe sur Terre en très faibles quantités. Il est créé dans l’atmosphère par réaction des neutrons cosmiques sur l’azote:

Du fait de la localisation de sa production, la concentration en tritium dans les différentes zones terrestres varie très sensiblement. On a pu ainsi observer la variation du taux de tritium en fonction de la latitude, ou, dans le temps, en fonction de l’activité solaire. Dans les eaux de pluie sa concentration est de l’ordre de 10-18. La teneur en tritium de l’atmosphère a été considérablement modifiée par les explosions nucléaires. Le tritium est préparé industriellement en très grande quantité dans les réacteurs nucléaires, notamment dans les réacteurs à eau lourde où se produit la réaction n + DT + 塚. Il est généralement stocké sous forme moléculaire en phase gazeuse, sous forme d’eau tritiée ou sous forme de molécules organiques marquées. Lorsque les trois isotopes sont présents, le nombre de combinaisons possibles pour les molécules d’hydrogène ou d’eau est très élevé. La séparation de ces diverses variétés et la mesure de leurs constantes physiques ne peuvent toujours être réalisées. Citons les propriétés de l’eau tritiée: densité: 1,332; point de fusion à la pression normale: face=F0019 力 9 0C; point d’ébullition: face=F0019 力 104 0C. La masse atomique du tritium dans l’échelle du 12C est de 3,016 050 0 u.
Le tritium est radioactif 廓-. Sa période est de 12,26 ans et l’énergie maximale du spectre 廓 est de 18,1 keV:

Le dosage du tritium par sa radioactivité est délicat du fait de la faible énergie des électrons émis (énergie moyenne: 5,7 keV). Pour le détecter, on l’inclut généralement dans un matériau scintillant et on mesure l’intensité de la lumière émise, le long de la trajectoire électronique, avec un tube photomultiplicateur. Le tritium est généralement utilisé comme traceur en biochimie et en chimie organique. La valeur commode de sa période a été utilisée pour les mesures de datation des vins ou le marquage des eaux souterraines (son efficacité est souvent supérieure à celle de la fluorescéine, retenue par les substrats argileux).
Du fait de son fort coefficient de diffusion et de la très faible énergie de son rayonnement 廓-, le tritium est un corps radioactif relativement peu dangereux. Eu égard au rôle particulièrement important de l’hydrogène dans les éléments biochimiques, la dose maximale admissible légalement, en contamination interne, décroît cependant d’année en année.
Le noyau de l’atome de tritium, ou triton, composé de deux neutrons et d’un proton, possède un spin 1/2 et sa parité intrinsèque est positive. Son moment magnétique dipolaire est de 2,978 9 magnétons nucléaires. Le triton est utilisé fréquemment en physique nucléaire soit comme cible, soit comme projectile. Le triton intervient dans les réactions de fusion nucléaire.
Encyclopédie Universelle. 2012.