- МУЛЬТИПЛЕТНОСТЬ
-
-число 2S+1 возможных ориентации в пространстве полного спина атомной системы (где S -спиновое квантовое число системы). В случае LS -свя-зи (нормальной связи, см. Связь векторная )при L>=S (L - орбитальное квантовое число) M. равна числу возможных ориентации в пространстве полного момента J атомной системы (т. е. кратности вырождения уровня энергии). При L< S число возможных ориентации J равно 2L+ 1, однако и в этом случае M. наз. число 2S +1.
M. определяет расщепление уровня энергии на компоненты. Это расщепление обусловлено релятивистскими эффектами в атомной системе (гл. обр. спин-орбитальным взаимодействием), наз. тонким или мульти-плетным и определяется правилом интервалов Ланде. При 2S + 1 = 1, 2, 3, 4, 5, ... уровни энергии соответственно наз. синглетными, дублетными, триплетными, квартетными, квинтетными и т. д. Значение M. указывают слева вверху от полного обозначения уровня энергии: 2S+1LJ.
M. атомных систем определяется числом электронов в незаполненных оболочках, т. к. для замкнутых оболочек S=0. Так, для атома H и атомов щелочных элементов (один электрон во внеш. оболочке) возможны только дублетные состояния, т. к. для таких атомов S= = 1/2, для атомов щёлочноземельных элементов (два электрона во внеш. оболочке) - синглетные (S =0, спины электронов антипараллельны) и триплетные (S=1, спины электронов параллельны) состояния. Их обозначают:
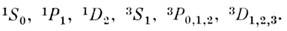
В случае LK-, jK- и jj -связи обозначения уровней энергии имеют более сложный вид. Так, для двухэлект-ронной конфигурации прп'р соответственно уровни L[K]J имеют вид
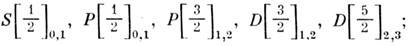
уровни j[K]J:
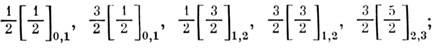
уровни [j1j2]J:
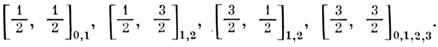
Для химически устойчивых молекул, имеющих, как правило, чётное число электронов, характерны M. 2S +1 = 1 для основного и 2S+1=1 и 2S+1 = 3 для возбуждённых состояний. В. П. Шевелько.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.