(от греч. atomos - неделимый), наименьшая частица хим. элемента, носитель его св-в. Каждому хим. элементу соответствует совокупность определенных А. Связываясь друг с другом, А. одного или разных элементов образуют более сложные частицы, напр. молекулы. Все многообразие хим. в-в (твердых, жидких и газообразных) обусловлено разл. сочетаниями А. между собой. А. могут существовать и в своб. состоянии (в газе, плазме). Св-ва А., в т. ч. важнейшая для химии способность А. образовывать хим. соед., определяются особенностями его строения.
Общая характеристика строения атома. А. состоит из положительно заряженного ядра, окруженного облаком отрицательно заряженных электронов. Размеры А. в целом определяются размерами его электронного облака и велики по сравнению с размерами _ядра А^ (линейные размеры А. ~ 10~8 см, его ядра ~ 10" -10" 13 см). Электронное облако А. не имеет строго определенных границ, поэтому размеры А. в значит. степени условны и зависят от способов их определения (см. Атомные радиусы). Ядро А. состоит из Z протонов и Nнейтронов, удерживаемых ядерными силами (см. Ядро атомное). Положит. заряд протона и отрицат. заряд электрона одинаковы по абс. величине и равны е= 1,60*10-19 Кл; нейтрон не обладает элек-трич. зарядом. Заряд ядра +Ze - осн. характеристика А., обусловливающая его принадлежность к определенному хим. элементу. Порядковый номер элемента в периодич. системе Менделеева (атомный номер) равен числу протонов в ядре.
В электрически нейтральном А. число электронов в облаке равно числу протонов в ядре. Однако при определенных условиях он может терять или присоединять электроны, превращаясь соотв. в положит. или отрицат. ион, напр. Li+, Li2+ или О -, О 2-. Говоря об А. определенного элемента, подразумевают как нейтральные А., так и ионы этого элемента.
Масса А. определяется массой его ядра; масса электрона (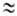 9,109*10-28 г) примерно в 1840 раз меньше массы протона или нейтрона (
9,109*10-28 г) примерно в 1840 раз меньше массы протона или нейтрона (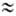 1,67*10-24 г), поэтому вклад электронов в массу А. незначителен. Общее число протонов и нейтронов А = Z + N наз. массовым числом. Массовое число и заряд ядра указываются соотв. верхним и нижним индексами слева от символа элемента, напр. 2311Na. Вид атомов одного элемента с определенным значением Nназ. нуклидом. А. одного и того же элемента с одинаковыми Z и разными Nназ. изотопами этого элемента. Различие масс изотопов мало сказывается на их хим. и физ. св-вах. Наиболее значит, отличия (изотопные эффекты )наблюдаются у изотопов водорода вследствие большой относит. разницы в массах обычного атома
1,67*10-24 г), поэтому вклад электронов в массу А. незначителен. Общее число протонов и нейтронов А = Z + N наз. массовым числом. Массовое число и заряд ядра указываются соотв. верхним и нижним индексами слева от символа элемента, напр. 2311Na. Вид атомов одного элемента с определенным значением Nназ. нуклидом. А. одного и того же элемента с одинаковыми Z и разными Nназ. изотопами этого элемента. Различие масс изотопов мало сказывается на их хим. и физ. св-вах. Наиболее значит, отличия (изотопные эффекты )наблюдаются у изотопов водорода вследствие большой относит. разницы в массах обычного атома 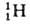 (протия), дейтерия D
(протия), дейтерия D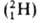 и трития Т
и трития Т 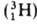 . Точные значения масс А. определяют методами масс-спектрометрии.
. Точные значения масс А. определяют методами масс-спектрометрии.
Квантовые состояния атома. Благодаря малым размерам и большой массе ядро А. можно приближенно считать точечным и покоящимся в центре масс А. и рассматривать А. как систему электронов, движущихся вокруг неподвижного центра - ядра. Полная энергия такой системы Еравна сумме кинетич. энергий Твсех электронов и потенциальной энергии U, к-рая складывается из энергии притяжения электронов ядром и энергии взаимного отталкивания электронов друг от друга. А. подчиняется законам квантовой механики; его осн. характеристика как квантовой системы - полная энергия Е - может принимать лишь одно из значений дискретного ряда Е 1 < Е 2 < Е 3 <>...; промежут. значениями энергии А. обладать не может. Каждому из "разрешенных" значений Есоответствует одно или неск. стационарных (с не изменяющейся во времени энергией) состояний А. Энергия Еможет изменяться только скачкообразно - путем квантового перехода А. из одного стационарного состояния в другое. Методами квантовой механики можно точно рассчитать Едля одноэлектронных А. - водорода и водородоподобных: Е= ЧhcRZ2/n2,> где h - постоянная Планка, с- скорость света, целое число п= 1, 2, 3, ... определяет дискретные значения энергии и наз. главным квантовым числом; R-постоянная Ридберга (hcR =13,6 эВ). При использовании СИ ф-ла для выражения дискретных уровней энергии одноэлектронных А. записывается в виде: 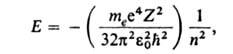
где т е-> масса электрона,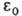 -электрич. постоянная,
-электрич. постоянная,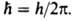 Возможные "разрешенные" значения энергии электронов в А. изображают в виде схемы уровней энергии - горизонтальных прямых, расстояния между к-рыми соответствуют разностям этих значений энергий (рис. 1). наиб. низкий уровень E1, отвечающий минимально возможной энергии, наз. основным, все остальные - возбужденными. Аналогично наз. состояния (основное и возбужденныеХ к-рым соответствуют указанные уровни энергии. С ростом пуровни сближаются и при
Возможные "разрешенные" значения энергии электронов в А. изображают в виде схемы уровней энергии - горизонтальных прямых, расстояния между к-рыми соответствуют разностям этих значений энергий (рис. 1). наиб. низкий уровень E1, отвечающий минимально возможной энергии, наз. основным, все остальные - возбужденными. Аналогично наз. состояния (основное и возбужденныеХ к-рым соответствуют указанные уровни энергии. С ростом пуровни сближаются и при 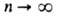 энергия электрона приближается к значению, отвечающему своб. (покоящемуся) электрону, удаленному из А. Квантовое состояние А. с энергией Еполностью описывается волновой ф-цией
энергия электрона приближается к значению, отвечающему своб. (покоящемуся) электрону, удаленному из А. Квантовое состояние А. с энергией Еполностью описывается волновой ф-цией 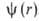 , где r-радиус-вектор электрона относительно ядра. Произведение
, где r-радиус-вектор электрона относительно ядра. Произведение 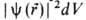 равно вероятности нахождения электрона в объеме dV, то есть
равно вероятности нахождения электрона в объеме dV, то есть 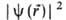 -плотность вероятности ( электронная плотность). Волновая ф-ция
-плотность вероятности ( электронная плотность). Волновая ф-ция 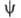 определяется уравнением Шрёдингера
определяется уравнением Шрёдингера 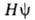 =
=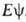 , где R-оператор полной энергии (гамильтониан).
, где R-оператор полной энергии (гамильтониан).
Наряду с энергией движение электрона вокруг ядра (орбитальное движение) характеризуется орбитальным моментом импульса (орбитальным мех. моментом) М 1; квадрат его величины может принимать значения, определяемые орбитальным квантовым числом l = 0, 1, 2, ...;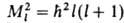 , где
, где 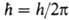 . При заданном и квантовое число l может принимать значения от 0 до (и Ч 1). Проекция орбитального момента на нек-рую ось z также принимает дискретный ряд значений М lz =
. При заданном и квантовое число l может принимать значения от 0 до (и Ч 1). Проекция орбитального момента на нек-рую ось z также принимает дискретный ряд значений М lz =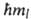 , где ml -магнитное квантовое число, имеющее дискретные значения от Ч l до +l(-l,... - 1, О, 1, ... + l), всего 2l+ 1 значений. Ось z для А. в отсутствие внеш. сил выбирается произвольно, а в магн. поле совпадает с направлением вектора напряженности поля. Электрон обладает также собственным моментом импульса -спином и связанным с ним спиновым магн. моментом. Квадрат спинового мех. момента М S2 =
, где ml -магнитное квантовое число, имеющее дискретные значения от Ч l до +l(-l,... - 1, О, 1, ... + l), всего 2l+ 1 значений. Ось z для А. в отсутствие внеш. сил выбирается произвольно, а в магн. поле совпадает с направлением вектора напряженности поля. Электрон обладает также собственным моментом импульса -спином и связанным с ним спиновым магн. моментом. Квадрат спинового мех. момента М S2 =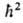 S(S>+ + 1) определяется спиновым квантовым числом S= 1/2, а проекция этого момента на ось z
S(S>+ + 1) определяется спиновым квантовым числом S= 1/2, а проекция этого момента на ось z 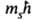
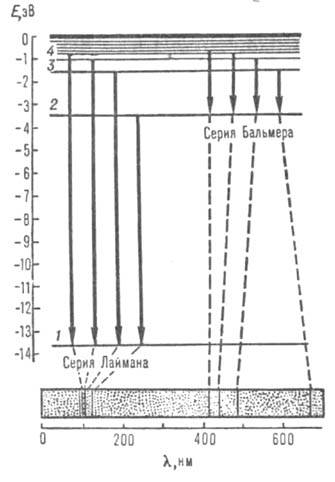
Рис. 1. Схема уровней энергии атома водорода (горизонтальные линии) и оптич. переходов (вертикальные линии). Внизу изображена часть атомного спектра испускания водорода - две серии спектральных линий; пунктиром показано соответствие линий и переходов электрона.
Стационарное состояние одноэлектронного А. однозначно характеризуется четырьмя квантовыми числами: п, l, ml и ms. Энергия А. водорода зависит только от п, и уровню с заданным псоответствует ряд состояний, отличающихся значениями l, ml,  , т. е. уровням со значениями п= 1, 2, 3, ... соответствуют 2, 8, 18, ..., 2n2 разл. квантовых состояний. Уровень, к-рому соответствует лишь одно квантовое состояние (одна волновая ф-ция), наз. невырожденным. Если уровню соответствует два или более квантовых состояний, он наз. вырожденным (см. Вырождение энергетических уровней). В А. водорода уровни энергии вырождены по значениям l и ml; вырождение по ms имеет место лишь приближенно, если не учитывать взаимод. спинового магн. момента электрона с магн. полем, обусловленным орбитальным движением электрона в электрич. поле ядра (см. Спин-орбитальное взаимодействие). Это - релятивистский эффект, малый в сравнении с кулоновским взаимод., однако он принципиально существен, т. к. приводит к дополнит. расщеплению уровней энергии, что проявляется в атомных спектрах в виде т. наз. тонкой структуры.
, т. е. уровням со значениями п= 1, 2, 3, ... соответствуют 2, 8, 18, ..., 2n2 разл. квантовых состояний. Уровень, к-рому соответствует лишь одно квантовое состояние (одна волновая ф-ция), наз. невырожденным. Если уровню соответствует два или более квантовых состояний, он наз. вырожденным (см. Вырождение энергетических уровней). В А. водорода уровни энергии вырождены по значениям l и ml; вырождение по ms имеет место лишь приближенно, если не учитывать взаимод. спинового магн. момента электрона с магн. полем, обусловленным орбитальным движением электрона в электрич. поле ядра (см. Спин-орбитальное взаимодействие). Это - релятивистский эффект, малый в сравнении с кулоновским взаимод., однако он принципиально существен, т. к. приводит к дополнит. расщеплению уровней энергии, что проявляется в атомных спектрах в виде т. наз. тонкой структуры.
При заданных n, l и ml квадрат модуля волновой ф-ции 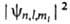 определяет для электронного облака в А. среднее распределение электронной плотности. Разл. квантовые состояния А. водорода существенно отличаются друг от друга распределением электронной плотности (рис. 2). Так, при l = 0 (s-состояния) электронная плотность отлична от нуля в центре А. и не зависит от направления (т. е. сферически симметрична), для остальных состояний она равна нулю в центре А. и зависит от направления.
определяет для электронного облака в А. среднее распределение электронной плотности. Разл. квантовые состояния А. водорода существенно отличаются друг от друга распределением электронной плотности (рис. 2). Так, при l = 0 (s-состояния) электронная плотность отлична от нуля в центре А. и не зависит от направления (т. е. сферически симметрична), для остальных состояний она равна нулю в центре А. и зависит от направления. 
Рис. 2. Форма электронных облаков для различных состояний атома водорода.
В многоэлектронных А. вследствие взаимного электростатич. отталкивания электронов существенно уменьшается прочность их связи с ядром. Напр., энергия отрыва электрона от иона Не + равна 54,4 эВ, в нейтральном атоме Не она значительно меньше - 24,6 эВ. Для более тяжелых А. связь внеш. электронов с ядром еще слабее. Важную роль в многоэлектронных А. играет специфич. обменное взаимодействие, связанное с неразличимостью электронов, и тот факт, что электроны подчиняются Паули принципу, согласно к-рому в каждом квантовом состоянии, характеризуемом четырьмя квантовыми числами, не может находиться более одного электрона. Для многоэлектронного А. имеет смысл говорить только о квантовых состояниях всего А. в целом. Однако приближенно, в т. наз. одноэлектронном приближении, можно рассматривать квантовые состояния отдельных электронов и характеризовать каждое одноэлектронное состояние (определенную орбиталъ, описываемую соответствующей ф-цией) совокупностью четырех квантовых чисел n, l, ml и 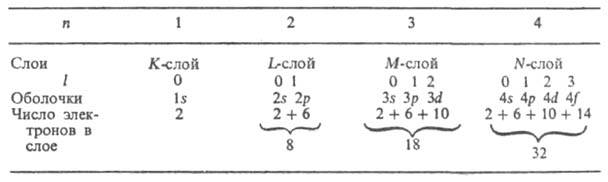
Прочность связи электрона в А., т. е. энергия, к-рую необходимо сообщить электрону, чтобы удалить его из А., уменьшается с увеличением п, а при данном п - с увеличением l. Порядок заполнения электронами оболочек и слоев в сложном А. определяет его электронную конфигурацию, т. е. распределение электронов по оболочкам в основном (невозбужденном) состоянии этого А. и его ионов. При таком заполнении последовательно связываются электроны с возрастающими значениями и и /. Напр., для А. азота (Z = 7) и его ионов N+, N2+, N3+, N4+, N5+ и N6+ электронные конфигурации имеют вид соотв.: Is22s22p3; Is22s22p2; Is22s22p; Is22s2; Is22s; Is2; Is (число электронов в каждой оболочке указывается индексом справа сверху). Такие же электронные конфигурации, как и у ионов азота, имеют нейтральные А. элементов с тем же числом электронов: С, В, Be, Li, He, Н (Z = 6, 5, 4, 3, 2, 1). Начиная с n = 4 порядок заполнения оболочек изменяется: электроны с большим п, но меньшим l оказываются связанными прочнее, чем электроны с меньшим пи большим l (правило Клечковского), напр. 4s-электроны связаны прочнее 3d-электронов, и сперва заполняется оболочка 4s, а затем 3d. При заполнении оболочек 3d, 4d, 5d получаются группы соответствующих переходных элементов; при заполнении 4f- и 5f-оболочек - соотв. лантаноиды и актиноиды. Порядок заполнения обычно соответствует возрастанию суммы квантовых чисел (п+ l); при равенстве этих сумм для двух или более оболочек сначала заполняются оболочки с меньшим и. Имеет место след. последовательность заполнения электронных оболочек: 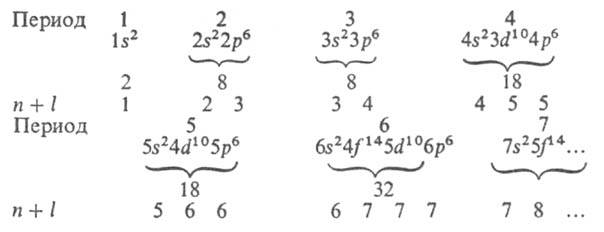
Для каждого периода указаны электронная конфигурация благородного газа, макс. число электронов, а в последней строке приведены значения п+ l. Имеются, однако, отступления от этого порядка заполнения (подробнее о заполнении оболочек см. Периодическая система химических элементов).
Между стационарными состояниями в А. возможны квантовые переходы. При переходе с более высокого уровня энергии Е i на более низкий Ek А. отдает энергию (Ei Ч Ek), при обратном переходе получает ее. При излучательных переходах А. испускает или поглощает квант электромагн. излучения (фотон). Возможны и безызлучательные переходы, когда А. отдает или получает энергию при взаимод. с др. частицами, с к-рыми он сталкивается (напр., в газах) или длительно связан (в молекулах, жидкостях и твердых телах). В атомарных газах в результате столкновения своб. А. с др. частицей он может перейти на др. уровень энергии - испытать неупругое столкновение; при упругом столкновении изменяется лишь кинетич. энергия постулат. движения А., а его полная внутр. энергия Еостается неизменной. Неупругое столкновение своб. А. с быстро движущимся электроном, отдающим этому А. свою кинетич. энергию, - возбуждение А. электронным ударом - один из методов определения уровней энергии А.
Строение атома и свойства веществ. Хим. св-ва определяются строением внеш. электронных оболочек А., в к-рых электроны связаны сравнительно слабо (энергии связи от неск. эВ до неск. десятков эВ). Строение внеш. оболочек А. хим. элементов одной группы (или подгруппы) периодич. системы аналогично, что и обусловливает сходство хим. св-в этих элементов. При увеличении числа электронов в заполняющейся оболочке их энергия связи, как правило, увеличивается; наиб. энергией связи обладают электроны в замкнутой оболочке. Поэтому А. с одним или неск. электронами в частично заполненной внеш. оболочке отдают их в хим. р-циях. А., к-рым не хватает одного или неск. электронов для образования замкнутой внеш. оболочки, обычно принимают их. А. благородных газов, обладающие замкнутыми внеш. оболочками, при обычных условиях не вступают в хим. р-ции.
Строение внутр. оболочек А., электроны к-рых связаны гораздо прочнее (энергия связи 102-104 эВ), проявляется лишь при взаимод. А. с быстрыми частицами и фотонами высоких энергий. Такие взаимод. определяют характер рентгеновских спектров и рассеяние частиц (электронов, нейтронов) на А. (см. Дифракционные методы). Масса А. определяет такие его физ. св-ва, как импульс, кинетич. энергия. От механических и связанных с ними магн. и электрич. моментов ядра А. зависят нек-рые тонкие физ. эффекты (ЯМР, ЯКР, сверхтонкая структура спектральных линий, см Спектроскопия).
Более слабые по сравнению с хим. связью электростатич. взаимод. двух А. проявляются в их взаимной поляризуемости - смещении электронов относительно ядер и возникновении поляризац. сил притяжения между А. (см. Межмолекулярные взаимодействия). А. поляризуется и во внеш. электрич. полях; в результате уровни энергии смещаются и, что особенно важно, вырожденные уровни расщепляются (см. Штарка эффект). А. может поляризоваться также под действием электрич. поля волны электромагн. излучения; поляризация зависит от частоты излучения, что обусловливает зависимость от нее показателя преломления в-ва, связанного с поляризуемостью А. Тесная связь оптич. св-в А. с его электрич. св-вами особенно ярко проявляется в оптич. спектрах.
Внеш. электроны А. определяют и магн. св-ва в-ва. В А. с заполненными внеш. оболочками его магн. момент, как и полный момент импульса (мех. момент), равен нулю. А. с частично заполненными внеш. оболочками обладают, как правило, постоянными магн. моментами, отличными от нуля; такие в-ва парамагнитны (см. Парамагнетики). Во внеш. магн. поле все уровни энергии А., для к-рых магн. момент не равен нулю, расщепляются (см. Зеемана эффект). Все А. обладают диамагнетизмом, к-рый обусловлен возникновением у них индуцированного магн. момента под действием внеш. магн. поля (см. Диэлектрики).
Св-ва А., находящегося в связанном состоянии (напр., входящего в состав молекул), отличаются от св-в своб. А. наиб. изменения претерпевают св-ва, определяемые внеш. электронами, принимающими участие в хим. связи; св-ва, определяемые электронами внутр. оболочек, могут при этом практически не изменяться. Нек-рые св-ва А. могут испытывать изменения, зависящие от симметрии окружения данного атома. Примером может служить расщепление уровней энергии А. в кристаллах и комплексных соед., к-рое происходит под действием электрич. полей, создаваемых окружающими ионами или лигандами.
Лит.: Карапетьянц М. X., Дракин С. И., Строение вещества, 3 изд., М., 1978; Шло лье кий Э. В., Атомная физика, 7 изд., т. 1-2, М., 1984. М. А. Ельяшевич.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.